题目内容
14.下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O32- | |
| B. | 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- | |
| C. | 0.1mol/LFe(NO3)2溶液:S2-、Na+、SO42-、Cl- | |
| D. | 0.1mol/LNaAlO2溶液:NH4+、K+、HCO3-、SO32- |
分析 A.使甲基橙变红色的溶液,显酸性;
B.常温下加水稀释时c(H+)/c(OH-)明显增大的溶液,显弱碱性;
C.离子之间结合生成沉淀;
D.AlO2-促进HCO3-的电离.
解答 解:A.使甲基橙变红色的溶液,显酸性,不能大量存在S2O32-,且Cu2+、I-发生氧化还原反应,故A错误;
B.常温下加水稀释时c(H+)/c(OH-)明显增大的溶液,显弱碱性,该组离子之间不反应,可大量共存,故B正确;
C.S2-、Fe2+结合生成沉淀,不能大量共存,故C错误;
D.AlO2-促进HCO3-的电离,不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,注重学生思维严密性的训练,题目难度不大.

练习册系列答案
相关题目
4.日常生活离不开洗涤剂.下列有关洗涤剂的使用不正确的是( )
| A. | 用纯碱溶液清洗餐具上油污 | B. | 用稀硫酸清洗水壶里水垢 | ||
| C. | 用漂白液洗涤白衬衣上红色墨迹 | D. | 用汽油清洗皮肤上的油漆 |
5.镇痛剂M(苯佐卡因)结构简式如图.下列说法正确的是( )


| A. | M分子式为C8H11NO2 | |
| B. | 1 mol M与NaOH溶液反应消耗1 mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
6.下列离子方程式书写正确的是( )
| A. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 4 mol•L-1的KAl(SO4)2溶液与7 mol•L-1的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O | |
| D. | 食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
3.短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法正确的是( )


| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y都存在同素异形现象 | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
7.下列实验操作不会引起误差的是( )
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知浓度的盐酸溶液时,锥形瓶使用前中含有少量水 | |
| D. | 用标准盐酸测定未知浓度NaOH溶液,结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
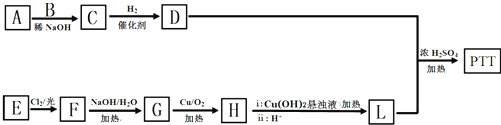
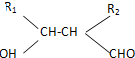
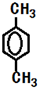 .
.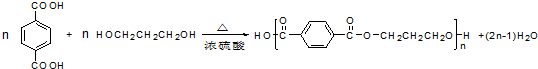 .
.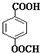 (填结构简式).
(填结构简式).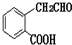 和CH3OH为有机原料制备化合物
和CH3OH为有机原料制备化合物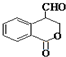 的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$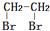 )
)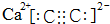 .
. 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: