题目内容
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为( )
| A、1 | B、3 | C、4 | D、6 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:质量数52,中子数28,则该元素原子的质子数为52-28=24,根据核外电子排布规律书写基态原子的电子排布式,据此判断.
解答:
解:质量数52,中子数28,则该元素原子的质子数为52-28=24,
故该元素基态原子的电子排布式为:1s22s22p63s23p63d54s1,
3d能级具有5个轨道,4个电子优先分别占据1个轨道,且自旋方法相同,故有6个成对电子,
故选D.
故该元素基态原子的电子排布式为:1s22s22p63s23p63d54s1,
3d能级具有5个轨道,4个电子优先分别占据1个轨道,且自旋方法相同,故有6个成对电子,
故选D.
点评:本题考查核外电子排布规律等,难度不大,理解核外电子排布规律,掌握核外电子排布规律是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将气体CO2通过MgCl2溶液中,若要有白色沉淀产生,可加入的试剂是( )
| A、KHSO4溶液 |
| B、CaCl2 |
| C、氯气 |
| D、NaOH溶液 |
以下元素基态原子电子排布图正确的是( )
A、 |
B、 |
C、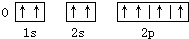 |
D、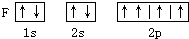 |
对于下列装置所示的实验,有关说法正确的是( )
A、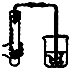 双手移去后,导管中水面与烧杯水面相平,则说明装置不漏气 |
B、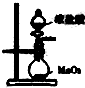 用于实验室制取Cl2 |
C、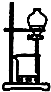 从海带中提取碘的实验过程中,用如图装置向烧杯中放出碘的苯溶液 |
D、 可用于实验室收集甲烷气体 |
下列物质反应后,产物与反应物的量无关的是( )
| A、二氧化碳与石灰水 |
| B、盐酸与偏铝酸钠溶液 |
| C、铝单质和氢氧化钠溶液 |
| D、硫酸铝和氢氧化钡溶液 |
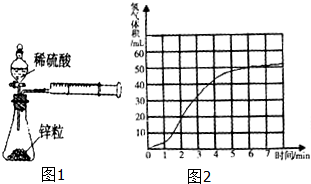 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.