题目内容
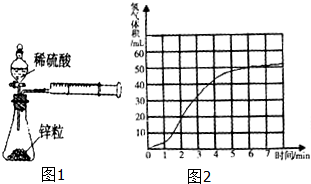 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.已知:①可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L硫酸、2mol/L硫酸 ②反应温度:25℃、35℃.请完成下列填空:
(1)盛装稀硫酸溶液的仪器名称是
(2)可用不同物质表示该反应的速率,该组设计了如下表格,请补充完成表格中的空白.
| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 | ||
| ① | 单位时间内Zn2+物质的量浓度的增加量 | v(Zn2+)=
| mol/(L?min) | ||
| ② |
| 编号 | 锌的形状 | 锌的规格 | 硫酸的浓度 | 反应温度 | 实验设计的目的 |
| ① | 块状 | 纯锌 | 1mol/L | 25℃ | Ⅰ.实验①和②研究 Ⅱ.实验②和③研究 Ⅲ.实验③和④研究 Ⅳ.实验④和⑤研究 |
| ② | 颗粒状 | 纯锌 | 1mol/L | 25℃ | |
| ③ | 颗粒状 | 纯锌 | 25℃ | ||
| ④ | 颗粒状 | 2mol/L | 25℃ | ||
| ⑤ | 颗粒状 | 粗锌 | 2mol/L | 35℃ | |
| … | |||||
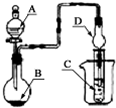
①0-1min时段内 ②1-4min时段内 ③4-6min时段内
(5)通过以上探究,该课题组还得出以下结论:在其它条件不变时,粗锌与稀硫酸反应比纯锌要快.分析原因是粗锌中含杂质铜,在稀硫酸中发生了原电池反应.请写出发生原电池时的电极反应式:
负极:
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)该实验中用分液漏斗盛装稀硫酸;
(2)比照①,该实验也可以用反应物浓度的减少量来表示化学反应速率;
(3)对比试验,找出不同点进行分析;
(4)由图可知,该曲线的斜率越大,产生氢气的速率越快;Zn与稀硫酸反应是放热反应,故反应速率最快与反应体系的温度有关;
(5)负极发生氧化反应,正极发生还原反应.
(2)比照①,该实验也可以用反应物浓度的减少量来表示化学反应速率;
(3)对比试验,找出不同点进行分析;
(4)由图可知,该曲线的斜率越大,产生氢气的速率越快;Zn与稀硫酸反应是放热反应,故反应速率最快与反应体系的温度有关;
(5)负极发生氧化反应,正极发生还原反应.
解答:
解:(1)该实验中用分液漏斗盛装稀硫酸,故答案为:分液漏斗;
(2)比照①,该实验也可以用反应物浓度的减少量来表示化学反应速率,
故答案为:单位时间内稀硫酸物质的量浓度的减少量;v(H2SO4)=
;mol/(L?min);
(3)Ⅰ.实验①和②锌的表面积不同;Ⅱ.实验②和③硫酸的浓度不同;Ⅲ.实验③和④研究锌的纯度不同;Ⅳ.实验④和⑤温度不同,
故答案为:锌的表面积;硫酸的浓度;锌的纯度;温度;
(4)由图可知,该曲线的斜率越大,产生氢气的速率越快;Zn与稀硫酸反应是放热反应,故反应速率最快与反应体系的温度有关,故答案为:②;因该反应是放热反应,此时温度高,反应速率加快;
(5)负极发生氧化反应,电极方程式为Zn-2e-=Zn2+,正极发生还原反应,电极方程式为Cu2++2e-=Cu,总反应为Zn+Cu2+=Zn2++Cu,
故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;Zn+Cu2+=Zn2++Cu.
(2)比照①,该实验也可以用反应物浓度的减少量来表示化学反应速率,
故答案为:单位时间内稀硫酸物质的量浓度的减少量;v(H2SO4)=
| △c(H2SO4) |
| △t |
(3)Ⅰ.实验①和②锌的表面积不同;Ⅱ.实验②和③硫酸的浓度不同;Ⅲ.实验③和④研究锌的纯度不同;Ⅳ.实验④和⑤温度不同,
故答案为:锌的表面积;硫酸的浓度;锌的纯度;温度;
(4)由图可知,该曲线的斜率越大,产生氢气的速率越快;Zn与稀硫酸反应是放热反应,故反应速率最快与反应体系的温度有关,故答案为:②;因该反应是放热反应,此时温度高,反应速率加快;
(5)负极发生氧化反应,电极方程式为Zn-2e-=Zn2+,正极发生还原反应,电极方程式为Cu2++2e-=Cu,总反应为Zn+Cu2+=Zn2++Cu,
故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;Zn+Cu2+=Zn2++Cu.
点评:本题考查学生影响化学反应速率的因素,难度不大,但是得分不容易.

练习册系列答案
相关题目
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃,101KPa条件下,24.5L的N2和CO混合气体含有的原子数大于2NA | ||
| B、15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1 mol SiO2中含有2 mol Si-O单键 | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
下列离子方程式正确的是( )
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O |
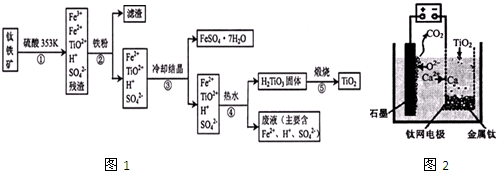
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )

| A、若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为二氧化锰,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为CaC2固体,C中盛溴水,则C中溶液褪色 |
下列说法正确的是( )
| A、在一定温度下,AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B、催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C、应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D、由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为( )
| A、1 | B、3 | C、4 | D、6 |
 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).