题目内容
绿矾(FeSO4?7H2O)是一种重要的食品和饲料添加剂.资料显示,硫酸亚铁在不同温度下的溶解度以及析出晶体的组成均不同.
在实验室里可以通过下列流程用废铁屑制备绿矾:
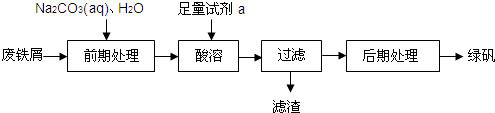
完成下列填空:
(1)使用Na2CO3(aq)作前期处理时,需要采取的措施是 .
A、冷却一段时间 B、常温放置一段时间 C、加热保温一段时间
(2)试剂a是 . 酸溶时,当看到 现象时应停止加热,并趁热过滤,所得滤渣中一定含有的物质是 .
(3)利用如图装置对所获产品(FeSO4?nH2O)中结晶水的含量进行测定.
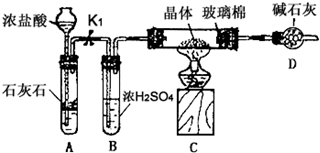
在称量C中的硬质玻璃管(82.112g)、装入晶体后的硬质玻璃管(86.282g)、D的质量(78.368g)后,实验步骤如下:

步骤I的目的是 ;操作甲是 ,操作丙是 (填写编号).
a、关闭K1 b、熄灭酒精灯 c、冷却到室温 d、烘干
(4)步骤 IV称得此时C中硬质玻璃管的质量为84.432g,D的质量为80.474g.产品硫酸亚铁晶体(FeSO4?nH2O)中n= ;相对误差为 .产生误差的可能原因是: 、 (选写2条).
| 温度(℃) | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度(g/100g水) | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.3 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||||

完成下列填空:
(1)使用Na2CO3(aq)作前期处理时,需要采取的措施是
A、冷却一段时间 B、常温放置一段时间 C、加热保温一段时间
(2)试剂a是
(3)利用如图装置对所获产品(FeSO4?nH2O)中结晶水的含量进行测定.

在称量C中的硬质玻璃管(82.112g)、装入晶体后的硬质玻璃管(86.282g)、D的质量(78.368g)后,实验步骤如下:

步骤I的目的是
a、关闭K1 b、熄灭酒精灯 c、冷却到室温 d、烘干
(4)步骤 IV称得此时C中硬质玻璃管的质量为84.432g,D的质量为80.474g.产品硫酸亚铁晶体(FeSO4?nH2O)中n=
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)碳酸钠溶液为碱性溶液,能够除去油污,且加热促进碳酸钠水解,碱性增强;
(2)要制备硫酸亚铁,所以要用稀硫酸溶解铁屑,为了防止亚铁离子被氧化,Fe不能全部消耗;
(3)二价铁易被氧化,所以要先通二氧化碳排尽装置中的氧气;然后点燃酒精灯加热;充分加热后,熄灭酒精灯,继续通二氧化碳,待冷却到室温,关闭K1停止通二氧化碳,最后称量固体的质量;
(4)根据已知数据求出水的质量和晶体的质量,根据二者的物质的量关系求出n;根据影响测定的水的质量的因素分析.
(2)要制备硫酸亚铁,所以要用稀硫酸溶解铁屑,为了防止亚铁离子被氧化,Fe不能全部消耗;
(3)二价铁易被氧化,所以要先通二氧化碳排尽装置中的氧气;然后点燃酒精灯加热;充分加热后,熄灭酒精灯,继续通二氧化碳,待冷却到室温,关闭K1停止通二氧化碳,最后称量固体的质量;
(4)根据已知数据求出水的质量和晶体的质量,根据二者的物质的量关系求出n;根据影响测定的水的质量的因素分析.
解答:
解:(1)碳酸钠溶液为碱性溶液,能够除去油污,且加热促进碳酸钠水解,碱性增强,去油污的能力增强,所以碳酸钠溶液要加热保温一段时间;
故答案为:洗油污;促进水解;
(2)要制备硫酸亚铁,所以要用稀硫酸溶解铁屑,为了防止亚铁离子被氧化,Fe不能全部消耗,则加入稀硫酸时当溶液中气泡较少时即停止加硫酸,防止Fe被耗尽;由于Fe有剩余,则过滤时滤渣中一定含有Fe;
故答案为:稀硫酸;溶液中气泡较少时;Fe;
(3)二价铁易被氧化,所以要先通二氧化碳排尽装置中的氧气;然后点燃酒精灯加热;充分加热后,熄灭酒精灯,继续通二氧化碳,待冷却到室温,关闭K1停止通二氧化碳,最后称量固体的质量;
故答案为:排尽装置中的空气,防止硫酸亚铁被氧化;b;a;
(4)通过以上数据得出,晶体质量为86.282g-82.112=4.170g,加热完全分解后剩余固体的质量为84.432g-82.112=2.320g,
所以
=
,解得n=6.734;
相对误差为
×100%=-3.8%;
求出的n的值比实际的值偏小,说明测量的水的质量偏小,①加热时间过短,结晶水未完全失去、②冷却结晶时,可能在56.7℃以上有晶体析出,则获得、③未进行恒重操作等均会使测量的水的质量偏小;
故答案为:6.734;-3.8%;加热时间过短,结晶水未完全失去、冷却结晶时,可能在56.7℃以上有晶体析出.
故答案为:洗油污;促进水解;
(2)要制备硫酸亚铁,所以要用稀硫酸溶解铁屑,为了防止亚铁离子被氧化,Fe不能全部消耗,则加入稀硫酸时当溶液中气泡较少时即停止加硫酸,防止Fe被耗尽;由于Fe有剩余,则过滤时滤渣中一定含有Fe;
故答案为:稀硫酸;溶液中气泡较少时;Fe;
(3)二价铁易被氧化,所以要先通二氧化碳排尽装置中的氧气;然后点燃酒精灯加热;充分加热后,熄灭酒精灯,继续通二氧化碳,待冷却到室温,关闭K1停止通二氧化碳,最后称量固体的质量;
故答案为:排尽装置中的空气,防止硫酸亚铁被氧化;b;a;
(4)通过以上数据得出,晶体质量为86.282g-82.112=4.170g,加热完全分解后剩余固体的质量为84.432g-82.112=2.320g,
所以
| 18n |
| 152 |
| 4.170-2.320 |
| 2.320 |
相对误差为
| 6.734-7 |
| 7 |
求出的n的值比实际的值偏小,说明测量的水的质量偏小,①加热时间过短,结晶水未完全失去、②冷却结晶时,可能在56.7℃以上有晶体析出,则获得、③未进行恒重操作等均会使测量的水的质量偏小;
故答案为:6.734;-3.8%;加热时间过短,结晶水未完全失去、冷却结晶时,可能在56.7℃以上有晶体析出.
点评:本题考查较为综合,涉及化学实验方案的评价以及相关计算等知识,侧重于学生的分析能力、实验能力、计算能力的考查,注意相关基础知识的积累,难度中等.

练习册系列答案
相关题目
将一定量的NaHCO3和NH4HCO3的混合物放入坩埚内,用酒精加热到质量不变时,最终称得残留物得质量是原来的一半,则原混合物中NH4HCO3的质量数为 ( )
| A、25% |
| B、20.75% |
| C、17.85% |
| D、26.45% |
工业上由重晶石制取可溶性钡盐,对已经粉碎后的矿石首先进行的处理方法应是( )
| A、水溶法 | B、酸溶法 |
| C、碱溶法 | D、还原法 |



 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: