题目内容
20.有机化合物 的官能团是( )
的官能团是( )| A. | 醛基 | B. | 羧基 | C. | 羟基 | D. | 醚键 |
分析 由结构分子中含-COOH,以此来解答.
解答 解: 的官能团为-COOH,名称为羧基,为羧酸类物质,
的官能团为-COOH,名称为羧基,为羧酸类物质,
故选B.
点评 本题考查有机物的官能团,为高频考点,侧重于学生的分析能力和应用能力的考查,把握常见的官能团为解答该题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.25℃时,在①0.01mol/L的盐酸,②pH=2的醋酸,③pH=12的氨水,④0.01mol/L的NaOH溶液4种溶液中,由水电离出的c(H+)的大小关系是( )
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
8.能使甲基橙变红色的溶液中,一定能大量共存的离子组是( )
| A. | K+、Na+、HCO3-、Cl- | B. | K+、AlO2-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、I- | D. | Al3+、NH4+、Cl-、SO42- |
15.0.3mol Cu2S与足量的浓HNO3反应,生成Cu(NO3)2、H2SO4、NO、H2O,则参加反应的硝酸中,未被还原的硝酸的量是( )
| A. | 75.3g | B. | 2.2mol | C. | 1.2mol | D. | 1mol |
5. 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A. | 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | |
| B. | 断开K1,闭合K2时,铜电极作正极 | |
| C. | 断开K2,闭合K1时,石墨电极附近溶液变红 | |
| D. | 断开K1,闭合K2时,铜电极上的电极反应为:H2-2e-=2H+ |
12.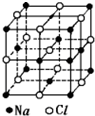 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
9.下列说法错误的是( )
| A. | 原子半径:F<Mg<K | B. | 碱性:Al(OH)3<Mg(OH)2<KOH | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>NH3 |
10.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg•cm-3,(ρ<1)溶质的质量分数为ω,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.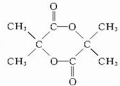 .
.