题目内容
3.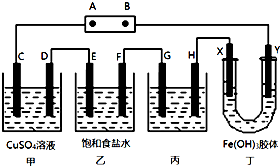 某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:(1)电源A 极的名称是正极(正极或负极).
(2)甲装置中的C极的电极反应式4OH--4e-=O2↑+2H2O.
(3)欲用丙装置给铜镀银,G应该是银(填“铜”或“银”),电镀液的主要成分是AgNO3(填化学式).
(4)装置丁中的现象是Y极附近红褐色变深.
分析 将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则可知A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,
(1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连;
(2)电解硫酸铜溶液生成硫酸、铜和氧气;
(3)给铜镀银,金属银作阳极,纯铜作阴极,含有银离子的盐作电解质;
(4)氢氧化铁胶粒带正电荷,向阴极移动,据此回答.
解答 解:将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则可知A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,
(1)由以上分析可知A是电源的正极,B是原电池的负极,故答案为:正极;
(2)电解硫酸铜溶液生成硫酸、铜和氧气,C是阳极,发生反应:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(3)给铜镀银,金属银作阳极,纯铜作阴极,含有银离子的盐硝酸银溶液作电解质,故答案为:银; AgNO3;
(4)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:Y极附近红褐色变深.
点评 本题考查电解原理,涉及电解和电镀,正确判断正负极及阴阳极是解本题关键,知道各个电极上发生的反应,会正确书写电极反应式,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
13.某有机化合物的结构如图,关于该化合物的下列说法正确的是( )
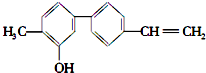

| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
14.X、Y、Z、W、Q都是短周期主族元素,其中X是短周期原子半径最大的元素,X与Y处于同一周期,Y与Z同主族且能形成两种常见的化合物,W能形成两种简单的离子,Q原子的电子总数等于其电子层数的3倍.下列说法正确的是( )
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
11.质量为a g的铜丝,在空气中灼热一段时间后,趁热放入下列物质中,充分反应后铜丝质量仍为ag的是( )
| A. | 盐酸 | B. | CO2 | C. | HNO3 | D. | 乙醇 |
18.有机物A和B分子中都有2个碳原子,室温时A为气体B为液体,A在催化剂作用下与水反应生成一种含氧化合物C.C经催化氧化生成B,则三种物质是( )
| A. | A是CH2=CH2 B是CH3CHO C是CH3CH2OH | |
| B. | A是CH3CHO B是CH2=CH2C是CH3CH2OH | |
| C. | A是CH≡CH B是CH3CH2OH C是CH3CHO | |
| D. | A是CH3CH2OH B是CH3-CH3C是CH≡CH |
8.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正方应为吸热反应 | |
| B. | 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 | |
| C. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行 |
15.钠与水反应的现象与钠的下列性质无关的是( )
| A. | 钠的熔点较低 | B. | 钠的密度较小 | ||
| C. | 钠的失电子能力较强 | D. | 钠的导电性 |
12.下列有关说法正确的是( )
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液的Kac(H+)值减小到原来的$\frac{1}{10}$ |