题目内容
18.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
分析 气体之间不发生化学反应就能共存;浓硫酸是酸能和碱性气体发生反应,浓硫酸有强氧化性能与强还原性的气体反应,所以浓硫酸能干燥酸性气体或中性气体.
解答 解:A.SO2、H2S、Cl2三种气体之间,两两之间能发生反应,且H2S能被浓硫酸氧化,不能用浓硫酸干燥,故A错误;
B.SO2、NH3、O2三种气体之间不发生反应,但氨气是碱性气体,能和浓硫酸反应,所以氨气不能用浓硫酸干燥,故B错误;
C.HCl、HBr、HI三种气体,三种气体之间不发生反应,但是HI有较强还原性能和浓硫酸反应,所以HI不能用浓硫酸干燥,故C错误;
D.SO2、CO2、O2三种气体之间不发生反应,且这三种气体和浓硫酸不反应,所以能共存且能用浓硫酸干燥,故D正确.
故选D.
点评 本题考查了气体的共存与干燥,难度不大,注意浓硫酸不能干燥碱性气体和强还原性的气体.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
8.下列关于SO2性质的说法不正确的是( )
| A. | 能形成酸雨 | B. | 能使鲜花褪色 | ||
| C. | 是无色无味的气体 | D. | 能与NaOH溶液反应 |
13.飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降.飘尘在空气中与二氧化硫接触时,会使其转化为三氧化硫,使空气酸度增加,飘尘所起的作用是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 吸附剂 |
3.有一瓶Na2SO3溶液,可能部分被氧化.某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀硝酸,充分振荡后仍有白色沉淀.对此实验下列结论正确的是( )
| A. | Na2SO3已部分氧化 | |
| B. | 加入硝酸钡溶液生成的沉淀一定含BaSO4 | |
| C. | 加入硝酸后的沉淀一定含BaSO3 | |
| D. | 此实验不能确定Na2SO3是否部分氧化 |
8.在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,测得C气体的浓度为0.5mol/L.恒温下,将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )
| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
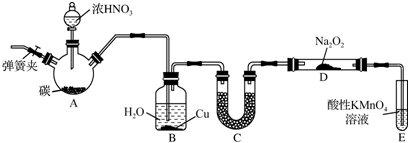
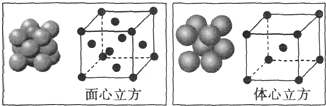 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
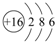 .
. .
.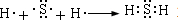 .
.