题目内容
18. 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)(1)铅蓄电池的优点:电压稳定、使用方便、安全可靠、价格低廉等;放电时,Pb电极质量将增大(填“增大”、“减小”)充电时,PbO2电极应该连接在外接电源的正极(填“正极”或“负极”),该电极反应式为:PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq)
(2)工业用PbO2来制备KClO4的工业流程如下:
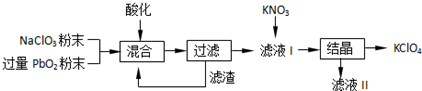
①KNO3、KClO4、NaClO4、NaNO3中,溶解度较小的是KClO4.
②写出NaClO3与PbO2反应的离子方程式为PbO2+ClO3-+2H+=Pb2++ClO4-+H2O.
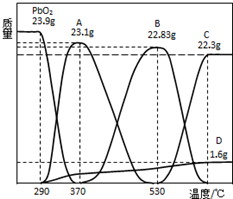
(3)已知PbO2可随温度升高逐步分解得到固体物质Pb2O3、Pb3O4或PbO,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如图所示.若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为Pb2O3和Pb3O4(写化学式).
(4)根据以上实验数据计算22.94g剩余固体中各组分的物质的量之比1:1.
分析 (1)根据铅蓄电池的特点可知,铅蓄电池电压稳定、使用方便、安全可靠、价格低廉,依据电池反应,放电过程是原电池反应,Pb电极做负极,发生氧化反应;充电过程是电解池,PbO2电极做电解池阳极;
(2)工业用PbO2来制备KClO4,是在酸性条件下用PbO2将NaClO3氧化成NaClO4,过滤得含有NaClO4的溶液中加入硝酸钾,经结晶可得KClO晶体,
①根据溶液中溶解度小的物质先析出,结合复分解反应的条件可判断溶解度较小的物质;
②NaClO3与PbO2反应,+4价的铅能将氯酸根氧化成高氯酸根,根据电荷守恒和元素守恒书写离子方程式;
(3)依据图象分析,可计算出A点和B点中铅和氧的物质的量之比,进而确定两个点的物质组成,剩余固体的质量为22.94g时,介于AB之间,据此判断;
(4)根据(3)中的计算,运用元素守恒可计算出各物质的物质的量之比.
解答 解:(1)根据铅蓄电池的特点可知,铅蓄电池的优点是电压稳定、使用方便、安全可靠、价格低廉等,放电过程是原电池反应,Pb电极做负极,发生氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4,生成的硫酸铅附着在铅电极上,所以其质量增加,充电过程是电解池,PbO2电极做电解池阳极,所以要与电源的正极相连,电极反应式为 PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq),
故答案为:电压稳定、使用方便、安全可靠、价格低廉等;增大;正极; PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq);
(2)①根据题中流程可知,KNO3和NaClO4反应能生成KClO4和NaNO3,结晶后得到KClO4,可推知KClO4的溶解度较小,
故答案为:KClO4;
②依据流程分析,二氧化铅是氧化剂把氯酸钾氧化为高氯酸钾,铅元素化合价降低为二价,反应在酸性溶液中进行,反应的离子方程式为:PbO2+ClO3-+2H+=Pb2++ClO4-+H2O,
故答案为:PbO2+ClO3-+2H+=Pb2++ClO4-+H2O;
(3)23.9gPbO2物质的量=$\frac{23.9g}{239g/mol}$=0.1mol,其中氧原子为0.2mol,图象中A点固体质量减少=23.9g-23,1g=0.8g,减少的是氧元素质量为0.05mol,所以剩余氧原子物质的量=0.2mol-0.05mol=0.15mol,剩余铅和氧原子物质的量之比=0.1mol:0.15mol=2:3,对应A点位置为Pb2O3;B点固体减少=23.9g-22.83g=1.07g,减少的氧原子物质的量=$\frac{1.07g}{16g/mol}$=0.07mol,剩余氧原子物质的量=0.2mol-0.07mol=0.13mol,反应剩余铅和氧原子物质的量之比=0.1mol:0.13mol≈3:4,剩余固体22.94g,介于AB之间,所以固体是Pb2O3和Pb3O4 的混合物,
故答案为:Pb2O3和Pb3O4;
(4)由(3)的计算可知,固体是Pb2O3和Pb3O4 的混合物,设Pb2O3物质的量为x,Pb3O4 物质的量为y,
得到2x+3y=0.1、3x+4y=0.2-$\frac{23.9-22.94}{16}$=0.14,
解得:x=y=0.02,
物质的量之比为1:1;
故答案为:1:1.
点评 本题以PbO2为情景设计考查原电池原理的应用,反应流程分析判断,有关图象分析和元素守恒的计算是解题关键,题目难度较大.

| A. | 甲醛是一种氧化物 | |
| B. | 甲醛中C、H、O的质量比为6:1:8 | |
| C. | 甲醛分子中含有氢分子 | |
| D. | 甲醛是由一个碳原子和一个水分子构成 |
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发.
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
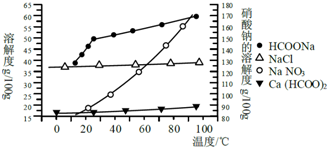
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH7~8;充分搅拌,所得溶液经蒸发结晶、趁热过滤、洗涤干燥得甲酸钙晶体;
(提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水)
| A. | 碳酸钙受热分解 | B. | 盐酸与氢氧化钠反应 | ||
| C. | 甲烷燃烧 | D. | 铝粉与盐酸反应 |
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | 砹化氢很稳定 | D. | 砹化银不溶于水 |
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 2-甲基丁烷.
2-甲基丁烷. 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.