题目内容
10.下列反应中反应物的总能量小于生成物的总能量的是( )| A. | 碳酸钙受热分解 | B. | 盐酸与氢氧化钠反应 | ||
| C. | 甲烷燃烧 | D. | 铝粉与盐酸反应 |
分析 反应中反应物的总能量小于生成物的总能量,说明该反应为吸热反应,常见的吸热反应有:①氢氧化钡晶体与氯化铵晶体的反应,②大多数分解反应,③C、氢气或CO为还原剂的氧化还原反应等,据此进行解答.
解答 解:反应中反应物的总能量小于生成物的总能量,说明该反应为吸热反应,
A.碳酸钙的分解反应为吸热反应,故A选;
B.盐酸与氢氧化钠的反应为中和反应,中和反应为放热反应,故B不选;
C.甲烷的燃烧反应为放热反应,故C不选;
D.铝粉与盐酸的反应为放热反应,故D不选;
故选A.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确反应物、生成物总能量与吸热反应、放热反应之间的关系为解答关键,注意掌握常见的吸热反应、放热反应,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
8.下列物质间的转化在给定条件下能实现的是( )
| A. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{H_{2}O}{→}$Cu(OH)2 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3溶液$\stackrel{NaOH、过滤、加热}{→}$Fe2O3 | |
| C. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| D. | Na$→_{△}^{O_{2}}$Na2O$\stackrel{CO_{2}}{→}$Na2CO3 |
1.某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
Ⅰ.合成苯甲酸甲酯粗产品在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g•cm-3),再小心加入
3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是催化剂、吸水剂;
(2)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH C6H5COOCH3+H218O.
C6H5COOCH3+H218O.
(3)甲和乙两位同学分别设计了如图1所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).

根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(4)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(5)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图2流程图进行精制,请在流程图中方括号内填入操作方法的名称.
(6)通过计算,苯甲酸甲酯的产率为65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是催化剂、吸水剂;
(2)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH
 C6H5COOCH3+H218O.
C6H5COOCH3+H218O.(3)甲和乙两位同学分别设计了如图1所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).

根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(4)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(5)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图2流程图进行精制,请在流程图中方括号内填入操作方法的名称.
(6)通过计算,苯甲酸甲酯的产率为65%.
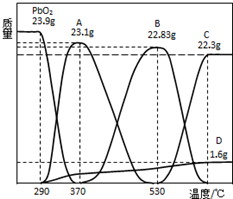 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)