题目内容
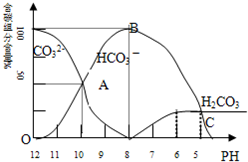 常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示.回答下列问题:
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示.回答下列问题:(1)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些?.
(2)请写出OAB段的离子方程式;当混合液的pH=时,开始放出CO2气体.
考点:离子方程式的有关计算
专题:计算题
分析:(1)当加入盐酸使溶液pH为10时,看图中A点得知;
(2)OAB段碳酸氢根离子浓度增大,碳酸根离子浓度减小,说明碳酸根离子和氢离子反应生成碳酸氢根离子;当溶液中H2CO3达到饱和后,开始放出CO2气体.
(2)OAB段碳酸氢根离子浓度增大,碳酸根离子浓度减小,说明碳酸根离子和氢离子反应生成碳酸氢根离子;当溶液中H2CO3达到饱和后,开始放出CO2气体.
解答:
解:(1)当加入盐酸使溶液pH为10时,由图象看出,碳元素的离子有CO32-、HCO3-,答:混合液中含碳元素的离子有CO32-、HCO3-;
(2)Na2CO3溶液中加入少量盐酸生成HCO3-,反应的离子方程式为CO32-+H+=HCO3-,当溶液中H2CO3达到饱和后,开始放出CO2气体,由图象可以看出,当pH=6时,H2CO3达到饱和,开始放出CO2气体,
答:离子反应为CO32-+H+=HCO3-;6.
(2)Na2CO3溶液中加入少量盐酸生成HCO3-,反应的离子方程式为CO32-+H+=HCO3-,当溶液中H2CO3达到饱和后,开始放出CO2气体,由图象可以看出,当pH=6时,H2CO3达到饱和,开始放出CO2气体,
答:离子反应为CO32-+H+=HCO3-;6.
点评:本题考查溶液离子浓度大小比较以及难溶电解质的溶解平衡及沉淀转化等问题,题目难度中等,注意分析图象曲线变化趋势,把握物质的性质.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,2.8g N2与C2H4的混合气体所含电子数为1.4 NA |
| B、标准状况下,1.12LNO与1.12O2的混合物中含有的原子数为0.2NA |
| C、Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为0.2NA |
D、32gS8单质中含有的S-S键个数为2NA |
下列离子方程式与所述事实相符且正确的是( )
| A、用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| B、用双氧水和稀硫酸可以雕刻印刷电路板:Cu+H2O2+2H+=Cu++2H2O |
| C、KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2 |
| D、澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O. |
 使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( )
使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( )| A、2:3 | B、1:1 |
| C、4:3 | D、8:9 |
 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的
Mg2+、Al3+、NH4+物质的量分别为( )
| A、2mol、3mol、6mol |
| B、3mol、2mol、6mol |
| C、2mol、3mol、4mol |
| D、3mol、2mol、2mol |
两种有机物以一定比例混合,一定条件下在aL O2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中符合此条件的是( )
| A、CH4 C2H4 |
| B、CH3OH CH3COOH |
| C、C2H6 HCHO |
| D、HCHO CH3COOCH3 |
 Ⅰ.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.取适量A进行铝热反应,产物中有单质B生成;请填空:
Ⅰ.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.取适量A进行铝热反应,产物中有单质B生成;请填空:
 某学习小组用乙醇与氢溴酸为原料制备溴乙烷.该反应发生的原理为:C2H5OH+HBr
某学习小组用乙醇与氢溴酸为原料制备溴乙烷.该反应发生的原理为:C2H5OH+HBr