题目内容
17.下列离子方程式书写正确的是( )| A. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
分析 A.碳酸钙为难溶物,离子方程式中碳酸钙不能拆开;
B.铁与硫酸反应生成硫酸亚铁和氢气,不会生成铁离子;
C.氢氧化铜为难溶物,离子方程式中不能拆开;
D.锌与硫酸铜溶液反应生成硫酸锌和铜.
解答 解:A.碳酸钙属于难溶物,需要保留化学式,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.铁与稀硫酸发生反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故B错误;
C.氢氧化铜与盐酸反应,氢氧化铜需要保留化学式,正确的离子方程式为:2H++Cu(OH)2═Cu2++2H2O,故C错误;
D.Zn与硫酸铜溶液发生置换反应生成铜,反应的离子方程式为:Zn+Cu2+═Zn2++Cu,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
7.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 6.5g金属Zn与过量的硫酸反应,硫酸无论浓稀,转移电子数均为0.2Na | |
| B. | 含有1mol FeCl3的溶液中阴离子数等于3NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | Na2S和Na2O2 固体混合物15.6g中,含有的阴离子数为0.3NA |
5.设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A. | 27g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为10NA | |
| C. | 22.4 L氨气中含有N-H键的个数为3NA | |
| D. | Fe与水蒸气在高温条件下反应,有1mol Fe参与反应,则转移电子的数目为3NA |
12.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是液态;分离二者所采取的操作名称是蒸馏.
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.
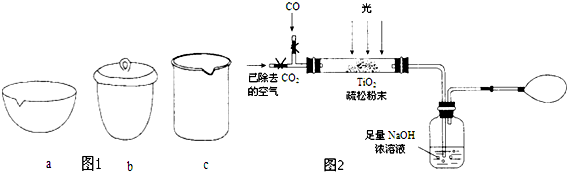
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
2.下列装置所示的实验,能达到实验目的是( )


| A. | 用装置A分离乙酸和乙酸乙酯 | B. | 用装置B收集NO气体 | ||
| C. | 用装罝C在实验室中制取氨气 | D. | 用装置D除去Cl2中的HC1 |
9.2012年12月7日日本明治奶粉检测出放射性核素铯13755Cs而被召回,下列有关铯原子(13755Cs)的说法错误的是( )
| A. | 原子序数为55 | B. | 电子数是55 | C. | 中子数是137 | D. | 质量数是137 |
6.将a克Fe2O3、Al2O3样品溶解在过量的200mL浓度为0.1mol•L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.4mol•L-1 | D. | 0.8mol•L-1 |
7.某同学将一小块钠放入盛有硫酸铜溶液的烧杯中,下列现象描述错误的是( )
| A. | 钠浮在水面上,四处游动 | |
| B. | 反应放出的热量使得钠熔化成一个小球 | |
| C. | 反应完后烧杯中有蓝色不溶物 | |
| D. | 反应完后烧杯中出现红色不溶物 |
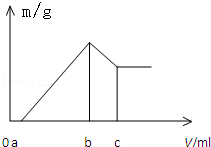 将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:
将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算: