题目内容
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L SO3含有0.5NA SO3分子 |
| B、7.8g Na2O2与足量CO2反应,转移的电子数为0.1NA |
| C、1mol C5H12中含有的共价键数为17NA |
| D、1L 0.1mol?L-1的Na2S溶液中含有0.1NA S2-离子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算11.2L三氧化硫的物质的量;
B、过氧化钠中氧元素为-1价,根据过氧化钠与二氧化碳反应生成氧气的物质的量计算出转移的电子数;
C、C5H12分子中含有4个碳碳共价键、12个碳氢共价键,总共含有16个共价键;
D、氯化钠溶液中硫离子部分水解,溶液中硫离子数目减少.
B、过氧化钠中氧元素为-1价,根据过氧化钠与二氧化碳反应生成氧气的物质的量计算出转移的电子数;
C、C5H12分子中含有4个碳碳共价键、12个碳氢共价键,总共含有16个共价键;
D、氯化钠溶液中硫离子部分水解,溶液中硫离子数目减少.
解答:
解:A、标况下,三氧化硫不是气体,题中条件无法计算三氧化硫的物质的量,故A错误;
B、7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠与足量的二氧化碳反应生成0.05mol氧气,转移了0.1mol电子,转移的电子数为0.1NA,故B正确;
C、1mol戊烷中含有5mol碳碳键、12mol碳氢键,总共含有16mol共价键,含有的共价键数为16NA,故C错误;
D、1L 0.1mol?L-1的Na2S溶液中含有溶质硫化钠0.1mol,由于硫离子部分水解,溶液中硫离子物质的量小于0.1mol,硫离子数目小于0.1NA ,故D错误;
故选B.
B、7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠与足量的二氧化碳反应生成0.05mol氧气,转移了0.1mol电子,转移的电子数为0.1NA,故B正确;
C、1mol戊烷中含有5mol碳碳键、12mol碳氢键,总共含有16mol共价键,含有的共价键数为16NA,故C错误;
D、1L 0.1mol?L-1的Na2S溶液中含有溶质硫化钠0.1mol,由于硫离子部分水解,溶液中硫离子物质的量小于0.1mol,硫离子数目小于0.1NA ,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,转移掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项B为易错点,注意过氧化钠中氧元素的化合价为-1价.

练习册系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、H+、Ag+、NO3-、Cl- |
| B、K+、Na+、NO3-、Cl- |
| C、NH4+、H+、SO42-、OH- |
| D、Ca2+、K+、CO32-、OH- |
下列说法正确的是( )
| A、含元素种类相同且相对分子质量相同而结构不同的化合物为同分异构体 |
| B、某有机物完全燃烧后只生成二氧化碳和水,说明该有机物可能是烃或烃的含氧衍生物 |
| C、等物质的量的甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷和氯化氢 |
D、乙烯与氯化氢加成反应的产物是 |
常温下,物质的量浓度均为0.01mol?L-1的醋酸溶液和盐酸,下列说法正确的是( )
| A、两溶液的pH相同 |
| B、分别加入足量锌片,盐酸生成的H2体积大 |
| C、分别稀释100倍后,醋酸浓度与盐酸浓度相等 |
| D、由水电离出的氢离子浓度均为1×10-12mol?L-1 |
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A、氢化物的稳定性:HnX>HnW,是因为HnX 分子间存在氢键 |
| B、原子序数:W>Y>Z>X |
| C、离子的还原性:X>W |
| D、原子半径:Y>Z>X |
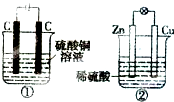 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积:①=② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑ |
| D、①中阴极质量增加,②中正极质量减小 |
下列反应的离子方程式正确的是( )
| A、过氧化钠投入水中:2Na2O2+2H2O═4Na++4OH-+O2↑ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ |
| D、向氯化亚铁溶液中滴入氯水:Fe2++Cl2═Fe3++2Cl- |

