题目内容
下列各项中,含氧原子数不同的是( )
| A、质量比为2:1的SO2和O2 |
| B、9g水和23g乙醇(C2H5OH) |
| C、标准状况下44.8L的一氧化氮和100 ml 5mol/L的硫酸溶液 |
| D、物质的量相同的Na2SO4和FeSO4 |
考点:物质分子中的原子个数计算
专题:计算题
分析:根据n=
=
=
结合物质的构成计算,含氧原子数相同,则氧原子物质的量相同.
| m |
| M |
| V |
| Vm |
| N |
| NA |
解答:
解:A.质量比为2:1的SO2和O2的物质的量之比为
:
=1:1,则含氧原子数相同,故A不选;
B.9g水的物质的量n(H2O)=
=0.5mol,氧原子物质的量为0.5mol,23g乙醇(C2H5OH)的物质的量n(C2H6O)=
=0.5moL,氧原子物质的量为0.5mol,则含氧原子数相同,故B不选;
C.标准状况下44.8L的一氧化氮的物质的量n(NO)=
=2mol,氧原子物质的量为2mol,n(H2SO4)=0.1L×5mol/L=0.5mol,含氧原子的物质的量为2mol,但溶液中含有水,所以氧原子的物质的量大于2mol,则含氧原子数不相同,故C选;
D.物质的量相同的Na2SO4和FeSO4含氧原子的物质的量之比为1:4,故D不选.
故选C.
| 2 |
| 64 |
| 1 |
| 32 |
B.9g水的物质的量n(H2O)=
| 9g |
| 18g/mol |
| 23g |
| 46g/ml |
C.标准状况下44.8L的一氧化氮的物质的量n(NO)=
| 44.8L |
| 22.4L/mol |
D.物质的量相同的Na2SO4和FeSO4含氧原子的物质的量之比为1:4,故D不选.
故选C.
点评:本题考查物质的量的计算,侧重于学生的计算能力的考查,注意把握物质的构成特点以及相关计算公式的运用,难度不大.

练习册系列答案
相关题目
下列有关物理量相应的单位,表达错误的是( )
| A、摩尔质量:g |
| B、气体摩尔体积:L?mol-1 |
| C、密度:g?mL-1 |
| D、物质的量浓度:mol?L-1 |
下列各组物质中分子数一定相同的是( )
| A、11.2 L H2和0.5 molCO2 |
| B、18 mL H2O(4℃)和2ⅹ105Pa,27℃32 g O2 |
| C、1 molCO和88 g CO2 |
| D、25℃,22.4 LCl2和含4 mol氧原子的H2SO4 |
下列物质按一定的分类方法,属于同一类的是( )
| A、标准状况下的状态:O2、CO2、H2O |
| B、酸性氧化物:SO2、Cl2O7、N2O5 |
| C、碱性氧化物:Na2O、CaO、Al2O3 |
| D、混合物:漂白粉、氯水、液氯 |
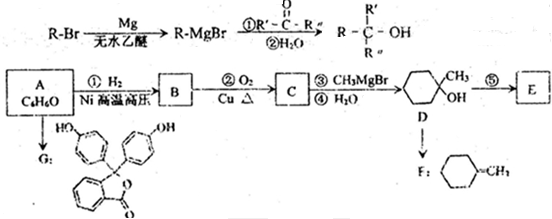
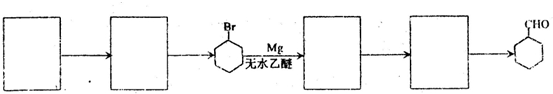
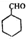 的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂.
的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂.