题目内容
物质A~H有转化关系(反应过程中产生的水在图中己略去),已知A是一种遇Ba(OH)2 能形成不溶于盐酸的白色沉淀,A与G、C与D、F与H元素组成分别相同,G和KSCN溶液混合后显红色.回答下列问题
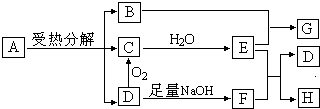
(1)写出A分解的化学方程式 ,当反应中转移的电子数目为3NA时,分解的A有 mol.
(2)若将C、D混合物与BaCl2溶液相混合可得到白色沉淀,沉淀的化学式是
(3)用A分解的产物D和C生产E,若D转化为C的过程中损失10%(其余过程全部转化),则1molA的分解产物可生成 molE.

(1)写出A分解的化学方程式
(2)若将C、D混合物与BaCl2溶液相混合可得到白色沉淀,沉淀的化学式是
(3)用A分解的产物D和C生产E,若D转化为C的过程中损失10%(其余过程全部转化),则1molA的分解产物可生成
考点:无机物的推断
专题:
分析:A是一种遇Ba(OH)2 能形成不溶于盐酸的白色沉淀,A中含有硫酸根,G和KSCN溶液混合后显红色,则G中含有Fe3+,由转化关系可知,Fe元素源于物质A,A与G元素组成相同,则A为FeSO4,G为Fe2(SO4)3,C与D组成分别相同,D氧化生成C,C与水反应生成E,且D能与氢氧化钠反应,考虑为酸性氧化物,D为SO2,C为SO3,E为H2SO4,F为Na2SO3,H为Na2SO4,B与E反应生成G,则B为Fe2O3,验证符合转化关系,据此解答.
解答:
解:A是一种遇Ba(OH)2 能形成不溶于盐酸的白色沉淀,A中含有硫酸根,G和KSCN溶液混合后显红色,则G中含有Fe3+,由转化关系可知,Fe元素源于物质A,A与G元素组成相同,则A为FeSO4,G为Fe2(SO4)3,C与D组成分别相同,D氧化生成C,C与水反应生成E,且D能与氢氧化钠反应,考虑为酸性氧化物,D为SO2,C为SO3,E为H2SO4,F为Na2SO3,H为Na2SO4,B与E反应生成G,则B为Fe2O3,验证符合转化关系,
(1)A分解的化学方程式为:2FeSO4
SO2↑+SO3↑+Fe2O3,反应中Fe元素化合价由+2升高为+3,当反应中转移的电子数目为3NA时,即转移电子为3mol,分解的A为
=3mol,
故答案为:2FeSO4
SO2↑+SO3↑+Fe2O3;3;
(2)若将SO2,SO3混合物与BaCl2溶液相混合可得到白色沉淀,沉淀的化学式是BaSO4,故答案为:BaSO4;
(3)由2FeSO4
SO2↑+SO3↑+Fe2O3,可知1mol FeSO4分解得到0.5mol SO2、0.5molSO3,若SO2转化为SO3的过程中损失10%(其余过程全部转化),根据S元素守恒,得到H2SO4为0.5mol+0.5mol×(1-10%)=0.95mol,故答案为:0.95.
(1)A分解的化学方程式为:2FeSO4
| ||
| 3mol |
| 3-2 |
故答案为:2FeSO4
| ||
(2)若将SO2,SO3混合物与BaCl2溶液相混合可得到白色沉淀,沉淀的化学式是BaSO4,故答案为:BaSO4;
(3)由2FeSO4
| ||
点评:本题考查无机物推断,注意根据白色沉淀判断A中含有硫酸根,G遇溶液混合后显红色判断G含有铁离子,进而推断A、G,再结合转化关系推断,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
下列各组物质中,不能满足“ ”转化关系的一组是
”转化关系的一组是
 ”转化关系的一组是
”转化关系的一组是| X | Y | Z | |
| A | CH2=CH2 | CH3CH2OH | CH3CH2Br |
| B | CH3CH2OH | CH3CHO | CH3COOH |
| C | C | CO | CO2 |
| D | HNO3 | NO | NO2 |
| A、A | B、B | C、C | D、D |
有关玻璃棒在实验中的用途及操作中,不正确的是( )
①物质溶解时用玻璃棒搅拌;
②用玻璃棒蘸少量溶液做焰色反应;
③测溶液pH时用玻璃棒蘸溶液;
④过滤时引流,玻璃棒下端靠在漏斗内滤纸的任意部位;
⑤配制一定物质的量浓度的溶液时要用玻璃棒引流;
⑥加热坩埚中硫酸铜晶体时用玻璃棒搅拌.
①物质溶解时用玻璃棒搅拌;
②用玻璃棒蘸少量溶液做焰色反应;
③测溶液pH时用玻璃棒蘸溶液;
④过滤时引流,玻璃棒下端靠在漏斗内滤纸的任意部位;
⑤配制一定物质的量浓度的溶液时要用玻璃棒引流;
⑥加热坩埚中硫酸铜晶体时用玻璃棒搅拌.
| A、①⑤ | B、③⑥ | C、②⑥ | D、②④ |
两种气态烃的混合物1L,在空气中完全燃烧生成1.5LCO2气体和2L水蒸气(均在标准状况下测定).关于混合物的说法正确的是( )
| A、一定有甲烷 |
| B、一定有乙烷 |
| C、一定含有甲烷,不一定含有乙烷 |
| D、可能是甲烷和丙烷的混合物 |
已知(CH3)2C=CH2可表示为 ,脱落酸属植物生长抑制剂,对该物质叙述正确的( )
,脱落酸属植物生长抑制剂,对该物质叙述正确的( )
 ,脱落酸属植物生长抑制剂,对该物质叙述正确的( )
,脱落酸属植物生长抑制剂,对该物质叙述正确的( )
| A、分子式为C15H22O4 |
| B、分子中所有碳原子可以在同一平面上 |
| C、1mol该物质最多可与3mol H2发生反应 |
| D、在一定条件下发生反应生成含七元环的物质 |
尼泊金酯是对羟基苯甲酸  与醇形成的酯类化合物,主要用作有机合成、食品、化妆品、医药的杀菌防腐剂,也用作于饲料防腐剂.下列说法中正确的是( )
与醇形成的酯类化合物,主要用作有机合成、食品、化妆品、医药的杀菌防腐剂,也用作于饲料防腐剂.下列说法中正确的是( )
 与醇形成的酯类化合物,主要用作有机合成、食品、化妆品、医药的杀菌防腐剂,也用作于饲料防腐剂.下列说法中正确的是( )
与醇形成的酯类化合物,主要用作有机合成、食品、化妆品、医药的杀菌防腐剂,也用作于饲料防腐剂.下列说法中正确的是( )| A、尼泊金乙酯与NaOH溶液反应时,可消耗1mol NaOH |
| B、尼泊金乙酯分子结构中,至少有6个碳原子在一个平面内 |
| C、尼泊金丁酯最多可与4mol H2发生加成反应 |
D、尼泊金丁酯是由对羟基苯甲酸与1-丁醇形成的酯,结构简式如图: |
