题目内容
求下列溶液的pH(常温条件下)(已知lg2=0.3)
(1)0.005mol?L-1的H2SO4溶液.
(2)已知CH3COOH的电离常数Ka=1.8×10-5,0.1mol?L-1的CH3COOH溶液.
(1)0.005mol?L-1的H2SO4溶液.
(2)已知CH3COOH的电离常数Ka=1.8×10-5,0.1mol?L-1的CH3COOH溶液.
考点:pH的简单计算
专题:
分析:(1)根据硫酸化学式可知c(H+)与硫酸浓度的关系,根据pH=-lg[c(H+)]计算该溶液的pH;
(2)根据醋酸的电离平衡常数等于醋酸根离子浓度和氢离子浓度乘与醋酸浓度的比值来计算.
(2)根据醋酸的电离平衡常数等于醋酸根离子浓度和氢离子浓度乘与醋酸浓度的比值来计算.
解答:
解:(1)该硫酸溶液中氢离子浓度为:c(H+)=2c(H2SO4)=2×0.005mol/L=0.01mol/L,
该硫酸溶液的pH为:pH=-lg[c(H+)]=-lg(0.01)=2,
答:该H2SO4溶液的pH为2;
(2)0.1mol/L的CH3COOH溶液中,CH3COOH的电离常数Ka=
=1.8×10-5,醋酸根离子和氢离子浓度相等,所以c(H+)=
=1.34×10-3mol/L,所以pH=-lg(1.34×10-3)≈3,
答:0.1mol?L-1的CH3COOH溶液pH为3.
该硫酸溶液的pH为:pH=-lg[c(H+)]=-lg(0.01)=2,
答:该H2SO4溶液的pH为2;
(2)0.1mol/L的CH3COOH溶液中,CH3COOH的电离常数Ka=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| 1.8×10-5×0.1 |
答:0.1mol?L-1的CH3COOH溶液pH为3.
点评:本题考查学生醋酸的电离平衡常数以及pH有关计算知识,难度不大.

练习册系列答案
相关题目
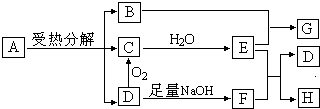
HPE是合成除草剂的重要中间体,其结构简式如图所示:下列有关HPE的说法正确的是( )
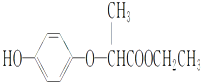

| A、1 mol HPE最多可以和2 mol NaOH反应 |
| B、HPE不能跟浓溴水反应 |
| C、HPE在1H核磁共振谱中有8种峰 |
| D、该物质不能发生在加成反应 |
 已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )
已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )| A、9种 | B、10种 |
| C、11种 | D、2种 |
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体粉末.下列有关叙述不正确的是( )
| A、表面迅速变暗是因为生成了氧化钠 |
| B、“出汗”是因为表面形成了NaOH溶液 |
| C、白色固体粉末是碳酸钠 |
| D、以上三个过程均发生了氧化还原反应 |
常温下,下列各组离子在指定环境下能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、SO32-、MnO4- |
| B、pH=7的溶液中:Na+、Al3+、Cl-、CO32- |
| C、pH>12的溶液中:Na+、K+、SO42-、AlO2- |
| D、pH=0的溶液中:Na+、I-、NO3-、ClO- |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO3=bO2↑+c Cl2↑+d HClO4+e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
| A、由反应可确定:氧化性HClO4>HClO |
| B、变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O=12H++10Cl-+2IO3- |
| C、若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示:26HClO3=15O2↑+8C12↑+10HClO4+8H2O |
| D、若化学计量数a=8,b=3,则该反应转移电子数为10e- |
表示下列变化的化学用语正确的是( )
| A、NaHCO3的水解:HCO3-+H2O?H3O++CO32- | ||||
| B、1L 0.5mol?L-1稀硫酸与1L 1mol?L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(1);△H=-57.3 kJ/mol | ||||
| C、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | ||||
D、以惰性电极电解KCl溶液:2Cl-+2H2O
|