题目内容
5.雌二醇的结构简式如图,下列说法不正确的是( )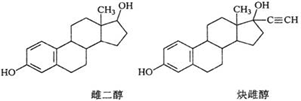
| A. | 能与Na、NaOH溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeCl3溶液发生显色反应,但不能与O2发生氧化反应 |
分析 A.两种分子中均含酚-OH;
B.均含苯环和-OH;
C.两种分子中均含多个四面体构型的亚甲基;
D.两种分子中均含酚-OH,酚-OH极易氧化.
解答 解:A.含酚-OH,均与Na、Na0H溶液、Na2CO3溶液反应,故A正确;
B.均含苯环可发生加成反应,均含醇-OH可发生消去反应、取代反应,故B正确;
C.两种分子中均含多个四面体构型的亚甲基,则两种分子中所有碳原子不可能在同一个平面内,故C正确;
D.两种分子中均含酚-OH,可与FeCl3溶液发生显色反应,酚-OH极易氧化,能与O2发生氧化反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、醇的性质,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
13.下列说法正确的是( )
| A. | 向 0.1 mol/L的氨水中加少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 常温下,0.1 mol/L一元酸(HA)溶液的 pH=3,则该溶液中,c2(H+)=c(H+)×c(A-)+Kw | |
| C. | 向含有 1 mol KAl(SO4)2 的溶液中加入 Ba(OH)2 溶液得到沉淀的物质的量最多为 2 mol | |
| D. | 将 Ca(ClO)2、Na2SO3、FeCl3、NaAlO2 溶液蒸干均得不到原溶质 |
20.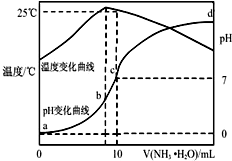 在某温度时,将nmol•L-1氨水滴入10mL1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1氨水滴入10mL1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将nmol•L-1氨水滴入10mL1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1氨水滴入10mL1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a点Kw=1.0×10-14 | |
| B. | 25℃时NH4Cl水解常数为:(n-1)×10-7mol•L-1(用n表示) | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 水的电离程度:b>c>a>d |
19.侯氏制碱法中,对母液中析出NH4Cl无帮助的操作是( )
| A. | 通入CO2 | B. | 通入NH3 | C. | 冷却母液 | D. | 加入食盐 |
20.下列说法不正确的是( )
| A. | 在汽油中加入乙醇热值改变 | |
| B. | 秸秆燃烧是造成雾霾的原因之一 | |
| C. | 用牺牲阴极的方法可以保护金属 | |
| D. | 自行车钢架生锈主要是电化学腐蚀所致 |
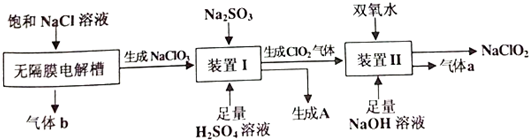
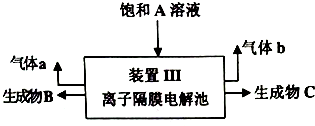

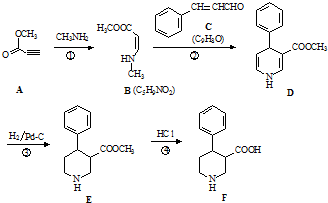
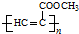 .
.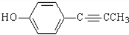 .
.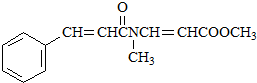 .
.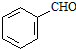 、CH3CH2OH和
、CH3CH2OH和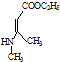 为原料,合成
为原料,合成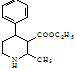 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).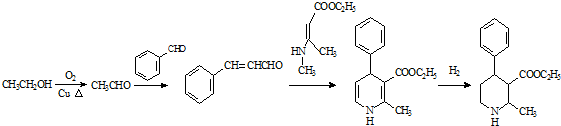
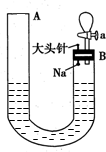 如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:
如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题: