题目内容
19. 由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.(1)写出浓硝酸与铜反应的离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)如图装置中NaOH溶液的作用是吸收氮氧化物.
反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有NaNO2与NaNO3(填化学式).
分析 (1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染;氮的氧化物与NaOH反应生成盐,以此来解答.
解答 解:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,所以装置中NaOH的作用是吸收氮氧化物,反应结束后,由NO2+NaOH→NaNO2+NaNO3+H2O可知,广口瓶的溶液中,除了剩余的NaOH外,还含有新生成的NaNO2与NaNO3,
故答案为:吸收氮氧化物;NaNO2与NaNO3.
点评 本题考查物质的性质实验,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意化学与环境及实验技能,题目难度不大.

练习册系列答案
相关题目
9.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示.下列分析不正确的是( )
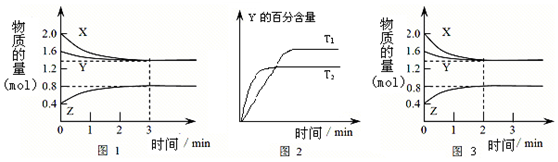

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 0~3min内,v(X)=0.1 mol/(L•min) | |
| C. | 达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正<v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
14. 化合物M叫假蜜环菌甲素(其结构如图所示),它是香豆素类天然化合物.对M的性质叙述不正确的是( )
化合物M叫假蜜环菌甲素(其结构如图所示),它是香豆素类天然化合物.对M的性质叙述不正确的是( )
 化合物M叫假蜜环菌甲素(其结构如图所示),它是香豆素类天然化合物.对M的性质叙述不正确的是( )
化合物M叫假蜜环菌甲素(其结构如图所示),它是香豆素类天然化合物.对M的性质叙述不正确的是( )| A. | 在镍作催化剂并加热的条件下,1molM最多可与5molH2发生加成反应 | |
| B. | M能使酸性KMnO4溶液褪色 | |
| C. | M可在热的NaOH溶液中发生反应,最多可消耗3molNaOH | |
| D. | 1molM可与3molBr2发生取代反应 |
4.下列关于物质的分类中,均正确的是( )
| A. | Cu丝--电解质;KOH--电解质 | |
| B. | NaCl--电解质;葡萄糖(C6H12O6)--非电解质 | |
| C. | NaCl溶液--非电解质;酒精--非电解质 | |
| D. | O2--不属于电解质或非电解质;MgCl2--非电解质 |
11.室温时下列溶液中的粒子浓度关系正确的是( )
| A. | 相同物质的量浓度的溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O中,c(NH4)由大到小的顺序是:①>③>②>④ | |
| B. | 将等体积的盐酸和氨水混合后pH=7:c(NH4+)>c(Cl-) | |
| C. | 0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
2.实验:①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液,过滤.
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
3.某气体由烯烃和烷烃混合而成,经测定其密度为同条件下H2的13倍,则下列说法中正确的是( )
| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有乙烯 | ||
| C. | 混合气体可能由甲烷和丙烯组成 | D. | 混合气体一定由乙烯和甲烷组成 |