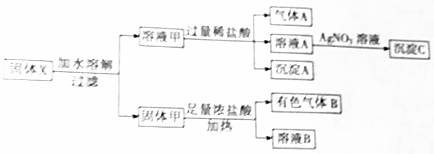
题目内容
11.将28.8g铁和硫化亚铁的混合物与足量的稀H2SO4充分反应,使生成的气体完全燃烧,将燃烧后的生成物通入盛浓H2SO4的洗气瓶,结果洗气瓶增重7.2g.已知:FeS+H2SO4→H2S↑+FeSO4求:
(1)混合物中铁和硫化亚铁各几克?
(2)把最后所得溶液稀释到500ml,求此溶液中FeSO4的物质的量浓度.
分析 铁和硫化亚铁的混合物与足量的稀H2SO4充分反应,分别发生Fe+H2SO4═FeSO4+H2↑、FeS+H2SO4=H2S↑+FeSO4,生成的气体为H2、H2S,由关系式H2~H2O、H2S~H2O可知生成水的物质的量等于H2、H2S之和,可知Fe、FeS的物质的量,结合质量可计算混合物中铁和硫化亚铁的质量,进而计算生成FeSO4的物质的量浓度.
解答 解:(1)铁和硫化亚铁的混合物与足量的稀H2SO4充分反应,分别发生Fe+H2SO4═FeSO4+H2↑、FeS+H2SO4=H2S↑+FeSO4,生成的气体为H2、H2S,由关系式H2~H2O、H2S~H2O可知生成水的物质的量等于H2、H2S之和,将燃烧后的生成物通入盛浓H2SO4的洗气瓶,结果洗气瓶增重7.2g,
可知n(H2)+n(H2S)=n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,
则n(Fe)+n(FeS)=0.4mol,
设Fe为xmol,FeS为ymol,
则$\left\{\begin{array}{l}{x+y=0.4}\\{56x+88y=28.8}\end{array}\right.$,
x=0.2,y=0.2,
m(Fe)=0.2mol×56g/mol=11.2g,m(FeS)=0.2mol×88g/mol=17.6g,
答:混合物中铁和硫化亚铁各为11.2g、17.6g;
(2)n(FeSO4)=n(Fe)+n(FeS)=0.4mol,把最后所得溶液稀释到500mL,c(FeSO4)=$\frac{0.4mol}{0.5L}$=0.8mol/L,
答:此溶液中FeSO4的物质的量浓度为0.8mol/L.
点评 本题考查混合物计算、根据方程式计算,为高频考点,题目难度中等,明确发生反应的原理为解答关键,注意Fe、FeS在反应中发生与硫酸反应,试题培养了学生的分析能力及化学计算能力.

| A. | 若1mol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023 | |
| B. | 0.1mol/L Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 室温下稀释0.1mol/L CH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小 | |
| D. | 向废水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 |
| A. | v(NH3)=0.02mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(N2)=0.01mol/(L•min) | D. | v(H2)=0.015mol/(L•min) |
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 少量CO2气体通入苯酚钠溶液中:2 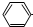 →O-+H2O+CO2→2 →O-+H2O+CO2→2 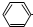 -OH+CO32- -OH+CO32- | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: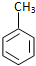 +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$ +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$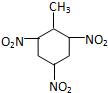 +3H2O +3H2O | |
| D. | 工业上通过苯与乙烯反应获得乙苯: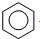 +CH2═CH2$→_{△}^{催化剂}$ +CH2═CH2$→_{△}^{催化剂}$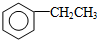 |
| A. | 1 mol K2O2中含有的阴、阳离子总数是4NA | |
| B. | 0.2molO3与6.72LO2均含有0.6NA个氧原子 | |
| C. | 常温常压下,22g P4O6与P4O10的混合物中含有氧原子的数目为0.6NA | |
| D. | 10gD216O所含的中子数为5NA |

| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |