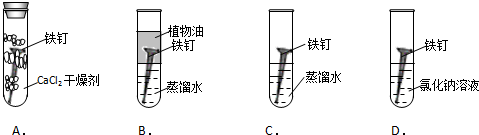
题目内容
1.固体粉末X中可能含有Fe2O3、MnO2、Na2SiO3、CaCl2、K2CO3中的若干种.为确定该固体粉末的成分,取X进行如下实验: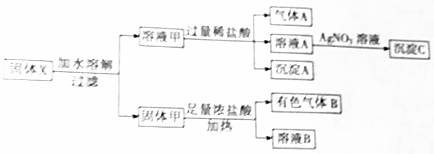
请回答:
(1)沉促A的化学式是H2SiO3.
(2)写出固体甲与浓盐酸反应生成有色气体B的离子方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)固体粉乘X中一定含有MnO2、Na2SiO3、K2CO3.
分析 有色气体B应为Cl2,说明一定含有MnO2,则固体甲含有MnO2,可能含有Fe2O3,溶液甲与盐酸反应生成沉淀A,应为H2SiO3,说明含有Na2SiO3,则一定不含有CaCl2,溶液A加硝酸银溶液生成沉淀,为AgCl,溶液甲加入盐酸生成气体A,说明含有K2CO3,以此解答该题.
解答 解:有色气体B应为Cl2,说明一定含有MnO2,则固体甲含有MnO2,可能含有Fe2O3,溶液甲与盐酸反应生成沉淀A,应为H2SiO3,说明含有Na2SiO3,则一定不含有CaCl2,溶液A加硝酸银溶液生成沉淀,为AgCl,溶液甲加入盐酸生成气体A,说明含有K2CO3,
(1)由以上分析可知沉淀A为H2SiO3,故答案为:H2SiO3;
(2)固体甲含有MnO2,与浓盐酸在加热条件下发生氧化还原反应生成氯气,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)由以上分析可知固体中一定含有MnO2、Na2SiO3、K2CO3,故答案为:MnO2、Na2SiO3、K2CO3.
点评 本题考查无机物的推断,涉及物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,注意体会.

练习册系列答案
相关题目
12.在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应:2A(g)+B(g)?3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是( )
| A. | 4molA+2molB | B. | 1.5molC+0.5molD | ||
| C. | 1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
 钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.