题目内容
12.说法正确的是( )| A. | 若1mol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023 | |
| B. | 0.1mol/L Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 室温下稀释0.1mol/L CH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小 | |
| D. | 向废水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 |
分析 A.过氧化钠中O为-1价,与水反应时自身发生氧化还原反应;
B.碳酸钠水解呈碱性,加热促进水解;
C.室温下,溶液中氢离子与氢氧根离子浓度之积为定值;
D.盐类的水解为吸热反应,加热促进电离.
解答 解:A.过氧化钠中O为-1价,与水反应时自身发生氧化还原反应,O元素化合价分别变为-2价、0价,则1mol Na2O2与足量水反应后产生氧气,理论上转移的电子数为6.02×1023,故A错误;
B.碳酸钠水解呈碱性,加热促进水解,则溶液的pH增大,故B错误;
C.室温下,溶液中氢离子与氢氧根离子浓度之积为定值,稀释醋酸,氢离子浓度减小,则氢氧根离子浓度增大,故C错误;
D.盐类的水解为吸热反应,加热促进电离,加热可促进铁离子水解,可生成氢氧化铁胶体,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握常见元素化合物的性质,难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
20.下列实验操作对应的图象不正确的是( )
| 选项 | A | B | C | D |
| 实验操作 | 向MgCl2、AlCl3溶液中(各1mol),逐滴加入NaOH溶液 | 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1mol),逐滴加入NaOH溶液 | 向NaOH、NaAlO2溶液中(各1mol),逐滴加入HCl溶液 | 向NaOH、Na2CO3混合溶液中(各1mol)滴加稀盐酸 |
| 图象 | 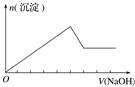 |  | 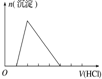 | 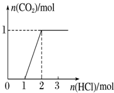 |
| A. | A | B. | B | C. | C | D. | D |
7.科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素的贡献,获得2015年诺贝尔医学奖,下列关于青蒿素(化学式C15H22O5)的说法错误的是( )
| A. | 青蒿素由碳、氢、氧三种元素组成 | |
| B. | 青蒿素分子中碳、氢、氧的原子个数比为:15:22:5 | |
| C. | 青蒿素中碳、氢、氧三种元素的质量比为:90:11:40 | |
| D. | 青蒿素的相对分子质量为282g |
17.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 它们对应的含氧酸都是强酸 |
 )是一种天然抗癌药物,在一定条件下能发生如下转化
)是一种天然抗癌药物,在一定条件下能发生如下转化
 ;
;
