��Ŀ����
 ��һ�������£�N2��g��+3H2��g��?2NH3��g����H=-93.0kJ?mol-1��
��һ�������£�N2��g��+3H2��g��?2NH3��g����H=-93.0kJ?mol-1����S=-93.0J?��mol?K��-1����l mol N2��3mol H2�����һ��10L�ܱ������У���Ӧ�ﵽƽ��ʱ��A���������а�ռ25%���Իش�
�ٸ��ݱ����������ݷ������÷�Ӧ�Է����е�����¶�Ϊ��
��A��ʱN2��Ũ��Ϊ
��ͼ����״̬Aʱ��ƽ�ⳣ�� KA=
�����ݻ��̶����ܱ������з���������Ӧ�������ʵ�Ũ�������
| ʱ��/min Ũ��/mol?L-1 | c ��N2�� | c ��H2�� | c ��NH3�� |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
a��ʹ�ô��� b�������¶� c������H2��Ũ�� d������Ne����ѹǿ��
���㣺��ѧƽ��ļ���,��ѧƽ���Ӱ������
ר�⣺��ѧƽ��ר��
�������١�H-T��S��0��Ӧ�Է����У��ݴ˷�����
����μӷ�Ӧ�ĵ��������ʵ���Ϊnmol����ϸ�������ʽ��n��ʾ������ֵ����ʵ����ı仯����ƽ��ʱ����ֵ����ʵ�������ϻ�������а�ռ25%���з������n��ֵ��
��ƽ�ⳣ��ָ������Ũ�ȵ�ϵ������֮���뷴Ӧ��Ũ��ϵ������֮���ı�ֵ��k=
���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У�ƽ�ⳣ��k��С��
���ȸ������ʹ�ʽ���N2�ķ�Ӧ���ʣ�Ȼ���������֮�ȵ��ڻ�ѧ������֮�ȣ����H2�ķ�Ӧ���ʣ����ݱ���֪��3min��ƽ�⽨�����̣���Ӧ���ʼӿ죬H2����û�����ӣ�������������Ի�ѧ��Ӧ���ʵ�Ӱ�죮
����μӷ�Ӧ�ĵ��������ʵ���Ϊnmol����ϸ�������ʽ��n��ʾ������ֵ����ʵ����ı仯����ƽ��ʱ����ֵ����ʵ�������ϻ�������а�ռ25%���з������n��ֵ��
��ƽ�ⳣ��ָ������Ũ�ȵ�ϵ������֮���뷴Ӧ��Ũ��ϵ������֮���ı�ֵ��k=
| c2(NH3) |
| c(N2)?c3(H2) |
���ȸ������ʹ�ʽ���N2�ķ�Ӧ���ʣ�Ȼ���������֮�ȵ��ڻ�ѧ������֮�ȣ����H2�ķ�Ӧ���ʣ����ݱ���֪��3min��ƽ�⽨�����̣���Ӧ���ʼӿ죬H2����û�����ӣ�������������Ի�ѧ��Ӧ���ʵ�Ӱ�죮
���
�⣺�١�H-T��S��0��Ӧ�Է����У���֪��S=-93.0J?��mol?K��-1����H=-93.0kJ?mol-1����-93000J?mol-1-��-93.0J?��mol?K��-1����T��0����T��600K��
�ʴ�Ϊ��600��
�ڶ��ڷ�Ӧ N2��g��+3H2��g�� 2NH3��g��
2NH3��g��
��ʼ��mol����1 3 0
�仯��mol����n 3n 2n
ƽ�⣨mol����1-n 3-3n 2n
����
��100%=25%�����n=0.4��
��c��N2��=
=0.06mol/L��
�ʴ�Ϊ��0.06��
��ƽ��ʱ�����ʵ�Ũ��Ϊc��N2��=0.06mol/L��c��H2��=0.18mol/L��c��N2��=0.08mol/L��
��K=
���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У�ƽ�ⳣ��k��С����KA��KB��
�ʴ�Ϊ��
������
��N2�ķ�Ӧ����ΪV=
=
mol?L-1?min-1����V��H2��=3V��N2��=0.08 mol?L-1?min-1��
���ݱ���֪��2min��ƽ�⽨�����̣���Ӧ���ʼӿ죬H2����û�����ӣ�������������Ի�ѧ��Ӧ���ʵ�Ӱ�죬��֪ʹ�ô����������¶Ⱦ��ɣ�����H2��Ũ���Dz���
�ʴ�Ϊ��0.08 mol?L-1?min-1��a��
�ʴ�Ϊ��600��
�ڶ��ڷ�Ӧ N2��g��+3H2��g��
 2NH3��g��
2NH3��g����ʼ��mol����1 3 0
�仯��mol����n 3n 2n
ƽ�⣨mol����1-n 3-3n 2n
����
| 2nmol |
| (1-n)mol+(3-3n)mol+2nmol |
��c��N2��=
| 0.6mol |
| 10L |
�ʴ�Ϊ��0.06��
��ƽ��ʱ�����ʵ�Ũ��Ϊc��N2��=0.06mol/L��c��H2��=0.18mol/L��c��N2��=0.08mol/L��
��K=
| 0.082 |
| 0.06��0.183 |
�ʴ�Ϊ��
| 0.082 |
| 0.06��0.183 |
��N2�ķ�Ӧ����ΪV=
| ��c(N2) |
| ��t |
| 0.08mol/L |
| 3min |
���ݱ���֪��2min��ƽ�⽨�����̣���Ӧ���ʼӿ죬H2����û�����ӣ�������������Ի�ѧ��Ӧ���ʵ�Ӱ�죬��֪ʹ�ô����������¶Ⱦ��ɣ�����H2��Ũ���Dz���
�ʴ�Ϊ��0.08 mol?L-1?min-1��a��
���������⿼���˷�Ӧ�Է��Ե��жϡ���ѧƽ����㡢ƽ�ⳣ���ļ����Ӧ�õȣ���Ŀ�Ѷ��еȣ�ּ�ڿ���ѧ����֪ʶ�����������ã�ע���ǿ����֪ʶ���������⣮

��ϰ��ϵ�д�
 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
�����Ŀ
ij��Һ�к���HCO3-��Na+��Ba2+��NO3-4�����ӣ��������м�������Na2O2�������Һ������Ũ�Ȼ������ֲ�����ǣ�������
| A��HCO3- |
| B��Na+ |
| C��Ba2+ |
| D��NO3- |
���л�ѧ������д��ȷ���ǣ�������
| A��NaHSˮ�ⷴӦ��HS-+H2O�TH3O++S2- | ||||
B�����������ȵ�Ũ���ᷴӦ��Fe+6HNO3��Ũ��
| ||||
C�� ��ͼװ����ʯī�缫�ϵĵ缫��ӦΪ��O2+4e-+2H2O=4OH- | ||||
D��ʪ����ͭ��ԭ����Cu2S+O2
|
�����Ͻ𣨳���Һ̬������Ϊ�˷�Ӧ�ѵ����Ƚ��ʣ�����˵����ȷ���ǣ�������
| A���úϽ���۵���ڽ����Ƶ��۵� |
| B�����������Ͻ�Ͷ��ˮ�еõ���ɫ��Һ������ʣ�࣬��n��Al����n��Na�� |
| C�����������Ͻ�Ͷ��FeCl3��Һ����Fe��OH��3�������� |
| D���������������Ͻ������ĺ���Խ�����������ᷴӦʱ�ų�������Խ�� |
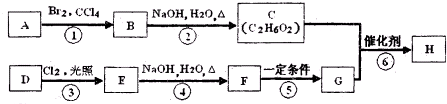
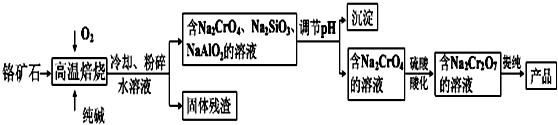
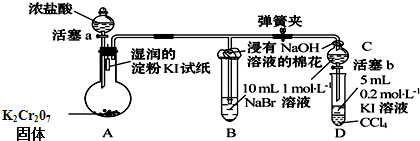
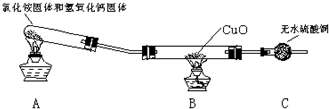
 ʵ��������480mL 0.05mol/L��FeSO4��Һ��ʵ����������У�
ʵ��������480mL 0.05mol/L��FeSO4��Һ��ʵ����������У�