题目内容
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,氨气能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 .
(2)实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气.
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
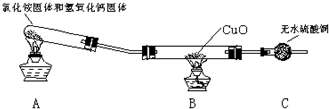
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 .
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体.请写出NH3与CuO反应的化学方程式 .
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu.请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A.冷却后称量,A的质量为72g.
据此可推得A为 ,请写出上述过程中发生反应的两个化学方程式 , ,由此得到的结论是 .
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式
(2)实验室还可在
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:

(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体.请写出NH3与CuO反应的化学方程式
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu.请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A.冷却后称量,A的质量为72g.
据此可推得A为
考点:氨的制取和性质
专题:氮族元素
分析:(一)制取氨气(1)实验室用氯化铵和消石灰反应制备氨气,依据化学反应方程式书写注意事项回答即可;
(2)用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
(二)(1)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
(2)由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(三)(1)根据Cu2O在酸性条件下不稳定的性质分析;
(2)根据颜色变化判断在不同温度下的产物,进而判断稳定性.
(2)用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
(二)(1)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
(2)由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(三)(1)根据Cu2O在酸性条件下不稳定的性质分析;
(2)根据颜色变化判断在不同温度下的产物,进而判断稳定性.
解答:
解:(一)(1)实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,故答案为:NaOH固体(或生石灰或碱石灰等);
(二)(1)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;
(4)CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3
3Cu+N2+3H2O,
故答案为:3CuO+2NH3
3Cu+N2+3H2O;
(三)(1)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(2)取98g Cu(OH)2固体,即n( Cu(OH)2)=1mol,加热至80℃~100℃时,得到黑色固体粉末,该黑色粉末为CuO,继续加热到1000℃以上,黑色粉末全部变为红色粉末A,则A为Cu2O,根据反应2Cu(OH)2
Cu2O+2H2O计算可得m(Cu2O)=n(Cu2O)×M(Cu2O)=0.5mol×144g/mol=72g,说明红色粉末为Cu2O,且Cu2O比CuO稳定,故答案为:Cu2O;2Cu(OH)2
Cu2O+2H2O;CuO+Cu(OH)2
Cu2O+2H2O;CuO比Cu2O的热稳定性差.
| ||
| ||
(2)用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,故答案为:NaOH固体(或生石灰或碱石灰等);
(二)(1)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;
(4)CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
(三)(1)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(2)取98g Cu(OH)2固体,即n( Cu(OH)2)=1mol,加热至80℃~100℃时,得到黑色固体粉末,该黑色粉末为CuO,继续加热到1000℃以上,黑色粉末全部变为红色粉末A,则A为Cu2O,根据反应2Cu(OH)2
| ||
| ||
| ||
点评:本题考查氨气的制备方法及化学性质,题目难度中等,明确氨气的性质及实验基本操作方法是解题关键,试题侧重考查学生的分析、理解能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 ( )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确.
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确.
| A、④⑤ | B、①④ | C、②③⑤ | D、②⑤ |
下列实验操作正确的是( )
| A、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| B、测定某无色溶液的pH值时:用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| C、滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 |
| D、向某待测液中加入氢氧化钠并加热,将湿润的蓝色石蕊试纸靠近若变红,说明原溶液有NH4+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
在盐酸滴定NaOH溶液的实验中,以甲基橙为指示剂,滴到终点时的颜色变化是( )
| A、由黄色变红色 |
| B、由黄色变橙色 |
| C、由橙色变红色 |
| D、由红色变橙色 |
 在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,
在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,