题目内容
18.下列反应无论在低温还是高温下均为非自发反应的是( )| A. | 2Ag2O(s)═4Ag (s)+O2(g) | B. | 2CO2(g)═2CO(g)+O2 (g) | ||
| C. | 6C(s)+6 H2O(l)═C6H12O6 (s) | D. | CaCO3(s)═CaO(s)+2CO2(g) |
分析 反应自发进行的判断依据是△H-T△S<0;反应是吸热反应,熵变减小的反应,依据焓变熵变和温度分析判断.
解答 解:A、2Ag2O(s)═4Ag (s)+O2(g)反应是吸热反应,熵变增大的反应,在高温下能自发,故A不选;
B、2CO2(g)═2CO(g)+O2 (g)反应是吸热反应,熵变增大的反应,在高温下能自发,故B不选;
C、6C(s)+6 H2O(l)═C6H12O6 (s),反应是吸热反应,熵变减小的反应,无论在低温还是高温下均为非自发反应,故C选;
D、CaCO3(s)═CaO(s)+2CO2(g)反应是吸热反应,熵变增大的反应,在高温下能自发,故D不选;
故选C.
点评 本题考查了化学反应自发进行的判断方法,注意利用焓变、熵变的变化结合温度的利用△H-T△S<0自发进行即可解答,题目较简单.

练习册系列答案
相关题目
8.设NA表示阿伏伽德罗常数的值,下列说法中,正确的是( )
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 1molAl3+含有核外电子数为3NA | |
| C. | 常温常压下,1mol氧气所含的原子数为NA | |
| D. | 1molNaCl晶体中含有NA个Na+和NA个Cl |
9.某化工生产反应历程的能量变化如图所示,过程1没有使用催化剂,过程2使用催化剂,则可判断催化剂除了改变反应速率之外,还可以改变的是( )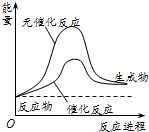

| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
6.由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,如图图所示中能较长时间看到Fe(OH)2白色沉淀的是( )
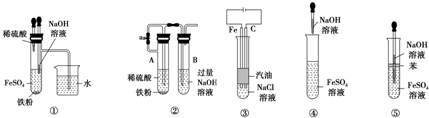

| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
10.恒温25℃,将两铂电极插入含一定量NaCl的饱和食盐水中进行电解.通电一段时间后,阳极收集到2.5mol气体,阴极收集到4.5mol气体(均不考虑气体的溶解或与溶液反应的损失),要使电解后溶液恢复到原状态,应加入( )
| A. | 4.5 mol HCl | B. | 2.5 mol H2O | ||
| C. | 108.5 g 33.6%的盐酸 | D. | 145 g 50.3%的盐酸 |
8.25℃时,水中存在电离平衡:2H2O?H3O++OH-△H>0.下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NH4Cl固体,抑制水的电离 | |
| C. | 向水中加入少量NaOH固体,促进水的电离 | |
| D. | 向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大,Kw不变 |
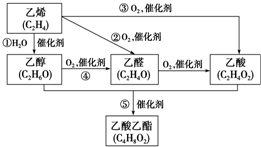 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线: ,乙醇中含氧官能团的名称是羟基;
,乙醇中含氧官能团的名称是羟基; 加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.
加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.