题目内容
13.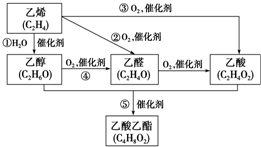 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线:(1)乙酸乙酯的结构简式为CH3COOCH2CH3;
(2)乙烯中官能团的符号是
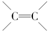 ,乙醇中含氧官能团的名称是羟基;
,乙醇中含氧官能团的名称是羟基;(3)请写出①、④反应的化学方程式:
①CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
④2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
(4)上述几种路线中涉及到的有机化学反应基本类型有反应④:氧化反应,反应⑤:酯化反应或取代反应.
分析 CH2=CH2发生催化反应生成CH3COOH,CH2=CH2和H2O发生加成反应生成CH3CH2OH,CH3CH2OH和氧气在催化剂条件下发生氧化反应生成CH3CHO,CH3CHO被催化氧化生成CH3COOH,CH2=CH2被催化氧化生成CH3CHO,CH3CH2OH和CH3COOH在浓硫酸作催化剂、加热条件下发生酯化反应生成CH3COOCH2CH3,据此分析解答.
解答 解:CH2=CH2发生催化反应生成CH3COOH,CH2=CH2和H2O发生加成反应生成CH3CH2OH,CH3CH2OH和氧气在催化剂条件下发生氧化反应生成CH3CHO,CH3CHO被催化氧化生成CH3COOH,CH2=CH2被催化氧化生成CH3CHO,CH3CH2OH和CH3COOH在浓硫酸作催化剂、加热条件下发生酯化反应生成CH3COOCH2CH3,
(1)通过以上分析知,乙酸乙酯结构简式为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
(2)CH2=CH2中官能团符号为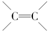 ,乙醇中含氧官能团的名称是羟基,故答案为:
,乙醇中含氧官能团的名称是羟基,故答案为: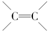 ;羟基;
;羟基;
(3)①反应为乙烯和水的加成反应,反应方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
④的反应为乙醇的催化氧化反应,反应方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
(4)通过以上分析知,④、⑤的反应类型分别是氧化反应、酯化反应或取代反应,故答案为:氧化反应;酯化反应(或取代反应).
点评 本题以烯烃、醇、醛、羧酸和酯之间的转化为载体考查有机物的合成,为高频考点,明确常见有机物官能团及其性质关系、常见有机反应类型、常见有机反应条件是解本题关键,知道反应中断键和成键方式,侧重考查学生分析判断能力,题目难度不大.

 53天天练系列答案
53天天练系列答案| A. |  干燥Cl2 | |
| B. |  配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
| A. | 按系统命名法,化合物CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是2-甲基-3,4-二乙基戊烷 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |

| A. | 若A是金属铁,则B溶液可使酸性高锰酸钾溶液褪色 | |
| B. | 若A、B、C中均含同一种常见金属元素,且该元素在C中以阴离子形式存在,则A溶液与C溶液可发生反应生成白色沉淀 | |
| C. | 若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则X不可能为直线形分子 | |
| D. | 若A为固态非金属单质,A与X同周期,则C中所有原子可能都满足8电子结构 |
| A. | 2Ag2O(s)═4Ag (s)+O2(g) | B. | 2CO2(g)═2CO(g)+O2 (g) | ||
| C. | 6C(s)+6 H2O(l)═C6H12O6 (s) | D. | CaCO3(s)═CaO(s)+2CO2(g) |
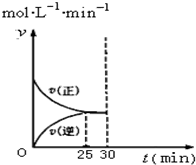 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:  | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
(2)T1温度下,0~10min内化学反应速率v(O2)=0.015mol•L-1•min-1,T2温度下的化学平衡常数K=0.56(不写单位).
(3)下列有关该反应的说法正确的是D.
A.T1温度时,反应在10min时的混合气体密度是30min时密度的0.6倍
B.T1温度时,反应在10min时的混合气体的平均相对分子质量与30min时相等
C.T2温度时,当c(SO2)=c(SO3)时达到化学平衡状态
D.T1、T2温度下分别达到化学平衡状态时,T1温度下压强小
(4)如图是在T1温度下的v-t图象.在T1温度下30min时将容器的体积缩小至0.5L,请在图象中画出在T1温度下重新达到平衡的图象(正反应速率和逆反应速率分别表示为v正′和v逆′).
| A. | 反应中Cl2是氧化剂,KOH是还原剂 | |
| B. | KCl是还原产物,KClO3是氧化产物 | |
| C. | 反应过程中3个氯分子共转移6个电子 | |
| D. | 被氧化的氯原子是被还原的氯原子的5倍 |
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{催化剂/△}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
(1)从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多.
(2)从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.