题目内容
8.25℃时,水中存在电离平衡:2H2O?H3O++OH-△H>0.下列叙述正确的是( )| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NH4Cl固体,抑制水的电离 | |
| C. | 向水中加入少量NaOH固体,促进水的电离 | |
| D. | 向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大,Kw不变 |
分析 水的电离是吸热反应,升高温度促进水电离,导致纯水中氢离子浓度增大,离子积常数增大,溶液的pH减小,酸、碱抑制水电离,含有弱离子的盐促进水电离,但离子积常数只与温度有关.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,导致纯水中氢离子浓度增大,离子积常数增大,溶液pH减小,故A错误;
B.向水中加入NH4Cl固体,铵根离子水解导致水平衡正向移动,c(OH-)减小,故B错误;
C.向水中加入少量NaOH固体,NaOH电离出的氢氧根离子抑制水电离,则水的平衡逆向移动,c(OH-)增大,故C错误;
D.向水中加入少量NaHSO4固体,c(H+)增大,溶液的pH减小,温度不变,KW不变,故D正确;
故选D.
点评 本题以水的离子积常数为载体考查水的电离,明确溶液中变化的离子确定水的电离平衡移动方向,注意离子积常数只与温度有关,与溶液酸碱性无关.

练习册系列答案
相关题目
18.下列反应无论在低温还是高温下均为非自发反应的是( )
| A. | 2Ag2O(s)═4Ag (s)+O2(g) | B. | 2CO2(g)═2CO(g)+O2 (g) | ||
| C. | 6C(s)+6 H2O(l)═C6H12O6 (s) | D. | CaCO3(s)═CaO(s)+2CO2(g) |
16.下列叙述正确的是( )
| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |
3.工业上目前使用两种方法制取乙醛:“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
(1)从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多.
(2)从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{催化剂/△}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
(1)从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多.
(2)从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
13.关于0.1mol•L-1 NaHCO3溶液,下列说法正确的是( )
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
17.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
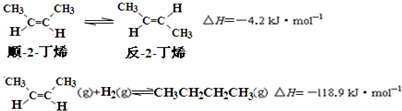
下列说法正确的是( )

下列说法正确的是( )
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: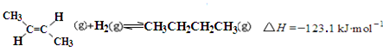 |
18.下列物质一定属于同系物的是( )
① ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦ ⑧
⑧
①
 ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ⑤和⑥ | D. | ④和⑧ |
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,