题目内容
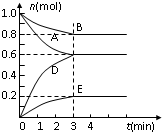 T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:(1)写出该反应的化学方程式
(2)反应开始至3min时,用D表示的平均反应速率为
(3)T℃时,该反应的化学平衡常数K=
(4)第6min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为
| 物质 | A | B | D | E |
| 物质的量mol | 0.8 | 1.0 | 0.4 | 0.2 |
考点:物质的量或浓度随时间的变化曲线,化学平衡的计算
专题:化学平衡专题
分析:(1)根据图中的数据,利用各物质变化的物质的量之比等于化学反应计量数之比,可写出化学方程式;
(2)根据v=
计算反应速率;
(3)根据生成物浓度系数次幂之积除以反应物浓度系数次幂之积计算平衡常数;
(4)在温度不变条件下,根据外界条件对平衡移动的影响作判断及体积之比等于物质的量之比计算D的体积分数;
(5)根据Qc与K比较,判断平衡移动方向,进而比较正逆反应速率大小;
(2)根据v=
| △c |
| △t |
(3)根据生成物浓度系数次幂之积除以反应物浓度系数次幂之积计算平衡常数;
(4)在温度不变条件下,根据外界条件对平衡移动的影响作判断及体积之比等于物质的量之比计算D的体积分数;
(5)根据Qc与K比较,判断平衡移动方向,进而比较正逆反应速率大小;
解答:
解:(1)根据图中的数据可知,AB的物质的量减小,DE物质的量增加,所以AB为反应物,DE为生成物,△n(A):△n(B):△n(D):△n(E)=0.4:0.2:0.6:0.2=2:1:3:1利用各物质变化的物质的量之比等于化学反应计量数之比,可写出化学方程式为2A+B 3D+E,故答案为:2A+B
3D+E,故答案为:2A+B 3D+E;
3D+E;
(2)反应开始至3min时,用D表示的平均反应速率为v=
=
=0.1mol/(L?min),故答案为:0.1mol/(L?min);
(3)根据生成物浓度系数次幂之积除以反应物浓度系数次幂之积计算平衡常数,因为E是固体,所以K=
=
=
;故答案为:
;
(4)在温度不变条件下,反应2A(g)+B(g) 3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:
3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:
=0.3,故答案为:0.3;
(5)根据表中数据可知,此时Qc=
=
<
;即Qc<K 反应未达平衡,要正向移动,所以v(正)>v(逆),故答案为:大于.
 3D+E,故答案为:2A+B
3D+E,故答案为:2A+B 3D+E;
3D+E;(2)反应开始至3min时,用D表示的平均反应速率为v=
| △c |
| △t |
| ||
| 3min |
(3)根据生成物浓度系数次幂之积除以反应物浓度系数次幂之积计算平衡常数,因为E是固体,所以K=
| c3(D) |
| c2(A)?c(B) |
(
| ||||
(
|
| 3 |
| 4 |
| 3 |
| 4 |
(4)在温度不变条件下,反应2A(g)+B(g)
 3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:
3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:| 0.6 |
| 0.6+0.6+0.8 |
(5)根据表中数据可知,此时Qc=
(
| ||||
(
|
| 1 |
| 4 |
| 3 |
| 4 |
点评:本题考查了根据图象写化学方程式、反应速率的计算、平衡常数的计算、平衡移动影响因素等知识,中等难度,本题的难点是平衡常数的计算和运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质不属于天然有机高分子的是( )
| A、淀粉 | B、蚕丝 |
| C、纤维素 | D、葡萄糖 |
下列属于物质的量的单位是( )
| A、摩尔 | B、千克 | C、秒 | D、安培 |
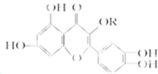 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以和溴水反应 |
| B、可用有机溶剂萃取 |
| C、1mol 维生素P可以和7mol H2反应 |
| D、1mol 维生素P可以和4mol NaOH反应 |
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示.下列有关说法不正确的是( )

| A、M与A均能使酸性高锰酸钾溶液和溴水褪色 |
| B、B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应 |
| C、A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
| D、1molM与热的烧碱溶液反应,可消耗2nmolNaOH |