题目内容
15.四种短周期主族元素X、Y、Z、W的原子序数依次增大,Y、Z原子的电子数之比为3:4;X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Y>Z | |
| C. | X和W形成的化合物属于离子化合物 | |
| D. | 由X、Y、Z三种元素组成的化合物一定显酸性 |
分析 四种短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,则甲为碱且为强碱溶液,短周期元素形成的强碱为NaOH,则X、Z、W分别是H、O、Na元素,Y、Z原子的电子数之比为3:4,则Y是C元素;
A.原子电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素非金属性越强,其氢化物的稳定性越强;
C.X、W分别是H、Na元素,二者形成的化合物是NaH;
D.X、Y、Z分别是H、C、O元素,三种元素形成的化合物可能是碳酸、醇、醛、羧酸、酯等.
解答 解:四种短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,则甲为碱且为强碱溶液,短周期元素形成的强碱为NaOH,则X、Z、W分别是H、O、Na元素,Y、Z原子的电子数之比为3:4,则Y是C元素;
A.原子电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是W>Y>Z>X,故A错误;
B.元素非金属性越强,其氢化物的稳定性越强,非金属性Z>Y,所以氢化物的稳定性Z>Y,故B错误;
C.X、W分别是H、Na元素,二者形成的化合物是NaH,NaH由阴阳离子构成,是离子化合物,故C正确;
D.X、Y、Z分别是H、C、O元素,三种元素形成的化合物可能是碳酸、醇、醛、羧酸、酯等,碳酸和羧酸具有酸性,但醛、醇、酯等没有酸性,故D错误;
故选C.
点评 本题考查原子结构和元素周期律关系,为高频考点,侧重考查学生分析推断及元素周期律的灵活运用,正确推断元素及灵活运用元素周期律是解本题关键,注意D中还要考虑有机物,为易错点.

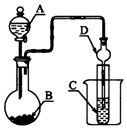
| A. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| B. | 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 | |
| D. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
| A. | 能使广泛pH试纸显红色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO3-、Cl- |
| A. | 足量铁在1molCl2中燃烧时转移电子数为2NA | |
| B. | 2L0.1mol•L-1氯化钾溶液中阴离子所带电荷数为NA | |
| C. | 1L0.1mol•L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 标准状况下,体积各为2.24L的HCl和NH3混合气体中含有的共价键数为0.25NA |
| A. | HCl | B. | (NH4)2SO4 | C. | CaCl2 | D. | CuSO4 |
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
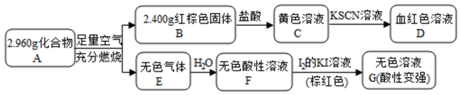
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.