题目内容
5.下列有关物质的性质与应用相对应的是( )| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
分析 A.依据盐类水解应用及油脂水解的性质;
B.依据铝密度小的性质解答;
C.依据金属冶炼方法解答;
D.浓硫酸做干燥剂是因为其具有吸水性.
解答 解:A.油脂为高级脂肪酸甘油酯,能够在碱性环境下水解生成可溶性物质,碳酸钠为强碱弱酸盐水解显碱性,所以可以用于洗去铁屑表面的油污,故A正确;
B.铝可用于作飞机、火箭的结构材料是因为其密度小,制成的合金机械性能强,与发生钝化无关,故B错误;
C.钠、镁、铝性质活泼的金属,用电解法制取,不能用碳还原法,故C错误;
D.浓硫酸做干燥剂是因为其具有吸水性,且不能与二氧化硫发生反应,故D错误;
故选:A.
点评 本题考查了元素化合物知识,侧重考查元素化合物用途,明确性质与用途之间的关系是解题关键,题目难度不大.

练习册系列答案
相关题目
15.四种短周期主族元素X、Y、Z、W的原子序数依次增大,Y、Z原子的电子数之比为3:4;X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Y>Z | |
| C. | X和W形成的化合物属于离子化合物 | |
| D. | 由X、Y、Z三种元素组成的化合物一定显酸性 |
13.光导纤维已成为信息社会必不可少的高技术材料,用于制造光导纤维的物质是( )
| A. | Si | B. | SiO2 | C. | Na2SiO3 | D. | CaSiO3 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐CaOCl2在酸性条件下可以产生Cl2,下列关于混盐CaOCl2 的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐具有较强的氧化性 | |
| C. | 该混盐中氯元素的化合价为零 | |
| D. | 该混盐与硫酸反应产生71gCl2时转移1mol 电子 |
17.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
4.“甲醇制取低碳烯烃技术(DMTO)”项目曾摘取了2014年度国家技术发明奖一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.回答下列有关问题:
(1)煤的气化.用化学方程式表示出煤的气化的主要反应:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化.下表中有些反应是煤液化过程中的反应:
①反应Ⅰ的平衡常数表达式为K1=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$.
②b>0(填“>”“<”或“=”),c与a、b之间的定量关系为c=a+b.
③K3=2.5(填具体的数值),若反应Ⅲ是在500℃、容积为2L的密闭容器中进行的,测得某一时刻体系内H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”“<”或“=”)CH3OH的消耗速率.
④对于反应Ⅲ在容器容积不变的情况下,下列措施可增加甲醇产率的是A、B.
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
(3)烯烃化阶段.如图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中Ⅰ、Ⅱ表示乙烯,Ⅲ表示丙烯).
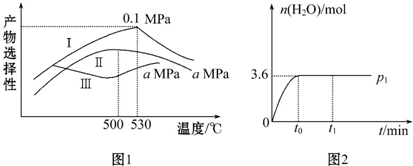
①为尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa.
②一定温度下某密闭容器中存在反应:2CH3OH(g)?CH2=CH2(g)+2H2O(g)△H>0.在压强为p1时,产物水的物质的量与时间的关系如图2所示,若t0时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字);若在t1时刻将容器容积快速扩大到原来的2倍,请在图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系图.
(1)煤的气化.用化学方程式表示出煤的气化的主要反应:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化.下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1=akJ•mol-1 | 2.5 | 0.2 |
| Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=bkJ•mol-1 | 1.0 | 2.3 |
| Ⅲ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3=ckJ•mol-1 | K3 | 4.6 |
②b>0(填“>”“<”或“=”),c与a、b之间的定量关系为c=a+b.
③K3=2.5(填具体的数值),若反应Ⅲ是在500℃、容积为2L的密闭容器中进行的,测得某一时刻体系内H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”“<”或“=”)CH3OH的消耗速率.
④对于反应Ⅲ在容器容积不变的情况下,下列措施可增加甲醇产率的是A、B.
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
(3)烯烃化阶段.如图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中Ⅰ、Ⅱ表示乙烯,Ⅲ表示丙烯).

①为尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa.
②一定温度下某密闭容器中存在反应:2CH3OH(g)?CH2=CH2(g)+2H2O(g)△H>0.在压强为p1时,产物水的物质的量与时间的关系如图2所示,若t0时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字);若在t1时刻将容器容积快速扩大到原来的2倍,请在图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系图.

 则该化合物的化学式为MgCNi3(用对应的元素符号表示).
则该化合物的化学式为MgCNi3(用对应的元素符号表示).
 .
.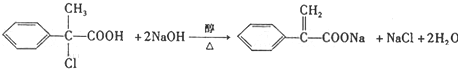 .
.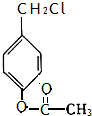 、
、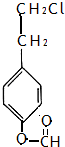 .
.