题目内容
14.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和 Cl2反应的2-产物之一为 SO42-下列说法不正确的是( )| A. | 该反应中的还原剂是 S2O32- | |
| B. | 根据该反应可判断氧化性:Cl2>SO42- | |
| C. | 上述反应中,每生成 1 mol SO42-,可脱去2molCl2 | |
| D. | 该反应的氧化产物是 Cl- |
分析 反应的离子方程式为S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,从化合价变化的角度分析氧化还原反应.
解答 解:反应的离子方程式为S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,则
A.反应中S元素的化合价升高,被氧化,则S2O32-为还原剂,故A正确;
B.氧化剂氧化性大于氧化产物的氧化性,反应中氧化性:Cl2>SO42-,故B正确;
C.由反应的方程式可知,每生成lmolSO42-,可脱去2molCl2,故C正确;
D.氯气是氧化剂,所以氯离子是还原产物,故D错误.
故选D.
点评 本题考查氧化还原反应,题目难度中等,解答该题的关键是能够写出反应的离子方程式.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )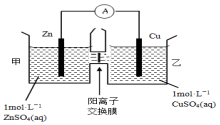

| A. | 铜电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
2.下列有关焰色反应的叙述正确的是( )
| A. | 只有金属的化合物灼烧时才会有不同的颜色 | |
| B. | 每次实验后,铂丝都要用水洗净 | |
| C. | 若透过蓝色钴玻璃只看到紫色,说明样品中含钾元素而一定不含钠元素 | |
| D. | 若样品灼烧呈黄色,判断一定有钠元素,但不能排除含其他金属元素 |
9.能正确表示下列反应的离子方程式是( )
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铝和氢氧化钠水溶液反应:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- $\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
19.已知有如下反应:
①2BrO3-+Cl2=Br2+2ClO3-,
②ClO3-+5Cl-+6H+=3Cl2+3H2O,
③2FeCl2+Cl2=2FeCl3.
根据上述反应,判断下列结论中错误的是( )
①2BrO3-+Cl2=Br2+2ClO3-,
②ClO3-+5Cl-+6H+=3Cl2+3H2O,
③2FeCl2+Cl2=2FeCl3.
根据上述反应,判断下列结论中错误的是( )
| A. | Cl2在①、③反应中是氧化剂 | |
| B. | 氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+ | |
| C. | 溶液中可发生:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O | |
| D. | Cl2是ClO3- 的还原产物 |
3.下列有关离子键和离子化合物的说法正确的是( )
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 在化合物MgCl2中,两个氯离子之间也存在离子键 | |
| C. | 离子化合物一定能导电 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
4.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 粗盐提纯时,为了加快过滤速率.可以用玻璃棒进行搅拌 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的最浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
 ;
;