题目内容
13.下列化学方程式,不正确的是( )| A. | Fe+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2 | B. | Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 | ||
| C. | N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO | D. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl |
分析 A.铁与氯气反应生成的是氯化铁,不是氯化亚铁;
B.铜与氯气在加热条件下反应生成硫化铜;
C.放电条件下,氮气与氧气反应生成NO气体;
D.氢气与氯气在光照条件下反应生成氯化氢.
解答 解:A.氯气具有强氧化性,Fe与氯气反应生成氯化铁,正确的化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,故A错误;
B.铜与氯气加热反应生成氯化铜,反应的化学方程式为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,故B正确;
C.氮气和氧气在放电条件下发生反应生成一氧化氮,反应的化学方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,故C正确;
D.在光照条件下,氢气与氯气发生反应生成HCl,反应的化学方程式为:H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl,故D正确;
故选A.
点评 本题考查了化学方程式的书写方法,题目难度不大,明确常见元素及其化合物性质为解答关键,注意掌握化学方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
5.某溶液中存在以下五种离子:0.2mol/L Cl-、0.4mol/L SO42-、0.1mol/L Al3+、0.3mol/L H+、M,则M及其物质的量浓度可能为( )
| A. | K+ 0.3mol/L | B. | Zn2+ 0.2mol/L | C. | CO32- 0.2mol/L | D. | Ca2+ 0.1mol/L |
8.等质量的下列物质所含分子数最多的是( )
| A. | 金刚石 | B. | 臭氧 | C. | 干冰 | D. | 纯碱 |
18.下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3④Al⑤AlCl3⑥Na2CO3.
①NaHCO3②Al2O3③Al(OH)3④Al⑤AlCl3⑥Na2CO3.
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
5.下列原子轨道重叠时,能形成π键的是( )
| A. | 只有py与py | B. | 只有pz与pz | ||
| C. | 只有dxy与py | D. | 上述三种情况都能 |
2.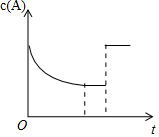 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )| A. | x=2,C为气态,D可能为气态也可能为非气态 | |
| B. | 改变的条件可能是使用了催化剂 | |
| C. | 其他条件不变,若向容器中再加入少量C,平衡逆向移动但平衡常数不变 | |
| D. | 该反应的化学平衡常数K=$\frac{{c}^{2}(C)}{[c(A)•c(B)]}$,且温度升高,K值增大 |
3.1mol•L-1 NaCl溶液的含义是( )
| A. | 1L水中含有1mol NaCl | |
| B. | 溶液中含有1mol NaCl | |
| C. | 1L溶液中含有58.5g NaCl | |
| D. | 将58.5g NaCl溶于1L水中所得的溶液 |
 某温度下的溶液中c(H+)=1.0×10x mol/L,c(OH-)=1.0×10y mol/L.x与y的关系如图所示.请回答下列问题:
某温度下的溶液中c(H+)=1.0×10x mol/L,c(OH-)=1.0×10y mol/L.x与y的关系如图所示.请回答下列问题: