题目内容
W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
(1)M在周期表中的位置为 ;
(2)Y与W形成的6核分子的结构式为 ;
(3)由W、Y、Z、M四种元素组成的两种离子化合物在溶液中相互反应的离子方程式为: .
(4)W2与Z2反应生成化合物甲,W2与Q2反应生成化合物乙.
已知反应:乙(g)+Z2(g)→甲(g)+Q2(g),每生成1molQ2放热56kJ.写出该反应的热化学方程式: ;
(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式: ,该反应的平衡常数表达式为 .
(6)将1mol丙气体和1mol丁气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少20%,则丁的转化率为 ;
②若仅将压强缩小为原来的一半,再次达平衡后,混合气体中戊的体积分数将 (填变大、变小或不变).
| X | ||
| M |
(2)Y与W形成的6核分子的结构式为
(3)由W、Y、Z、M四种元素组成的两种离子化合物在溶液中相互反应的离子方程式为:
(4)W2与Z2反应生成化合物甲,W2与Q2反应生成化合物乙.
已知反应:乙(g)+Z2(g)→甲(g)+Q2(g),每生成1molQ2放热56kJ.写出该反应的热化学方程式:
(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
(6)将1mol丙气体和1mol丁气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少20%,则丁的转化率为
②若仅将压强缩小为原来的一半,再次达平衡后,混合气体中戊的体积分数将
考点:元素周期律和元素周期表的综合应用
专题:
分析:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,
X属于第二周期元素,则X为C元素,W是H或Li元素,根据(3)题知,W是H元素,根据元素在周期表中的位置知,M是S元素,Z与M的最低负化合价相同,且Z原子序数小于M,所以Z是O元素,Y元素原子序数大于X而小于Z,所以Y是N元素,Q属于短周期主族元素且原子序数大于M,所以Q是Cl元素,
(1)根据M原子电子层数、最外层电子数确定在周期表中位置;
(2)Y与W形成的6核分子为肼,每个N原子连接两个H原子,N原子之间共用一个电子对;
(3)由W、Y、Z、M四种元素组成的两种离子化合物硫酸氢铵、亚硫酸氢铵或亚硫酸铵,二者反应生成二氧化硫和水;
(4)H2与O2反应生成化合物H2O,H2与Cl2反应生成化合物HCl,HCl和氧气反应生成水和氯气,每生成1molCl2放热56kJ,生成2mol氯气放出112kJ热量,据此书写其热化学反应方程式;
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁,丙是CO、丁是NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊,根据化合价变化知,戊是CO2,根据反应物、生成物及反应条件书写反应方程式,该反应的平衡常数表达式为
;
①若气体体积较原来减少20%,说明气体的物质的量减少20%,据此计算参加反应的丁的物质的量,从而计算丁的转化率;
②若仅将压强缩小为原来的一半,平衡向逆反应方向移动.
X属于第二周期元素,则X为C元素,W是H或Li元素,根据(3)题知,W是H元素,根据元素在周期表中的位置知,M是S元素,Z与M的最低负化合价相同,且Z原子序数小于M,所以Z是O元素,Y元素原子序数大于X而小于Z,所以Y是N元素,Q属于短周期主族元素且原子序数大于M,所以Q是Cl元素,
(1)根据M原子电子层数、最外层电子数确定在周期表中位置;
(2)Y与W形成的6核分子为肼,每个N原子连接两个H原子,N原子之间共用一个电子对;
(3)由W、Y、Z、M四种元素组成的两种离子化合物硫酸氢铵、亚硫酸氢铵或亚硫酸铵,二者反应生成二氧化硫和水;
(4)H2与O2反应生成化合物H2O,H2与Cl2反应生成化合物HCl,HCl和氧气反应生成水和氯气,每生成1molCl2放热56kJ,生成2mol氯气放出112kJ热量,据此书写其热化学反应方程式;
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁,丙是CO、丁是NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊,根据化合价变化知,戊是CO2,根据反应物、生成物及反应条件书写反应方程式,该反应的平衡常数表达式为
| c2(CO2).c(N2) |
| c2(CO).c2(NO) |
①若气体体积较原来减少20%,说明气体的物质的量减少20%,据此计算参加反应的丁的物质的量,从而计算丁的转化率;
②若仅将压强缩小为原来的一半,平衡向逆反应方向移动.
解答:
解:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,
X属于第二周期元素,则X为C元素,W是H或Li元素,根据(3)题知,W是H元素,根据元素在周期表中的位置知,M是S元素,Z与M的最低负化合价相同,且Z原子序数小于M,所以Z是O元素,Y元素原子序数大于X而小于Z,所以Y是N元素,Q属于短周期主族元素且原子序数大于M,所以Q是Cl元素,
(1)M原子核外有3个电子层、最外层电子数是6,则M位于第三周期第VIA族,故答案为:第三周期第VIA族;
(2)Y与W形成的6核分子为肼,每个N原子连接两个H原子,N原子之间共用一个电子对,其结构式为 ,故答案为:
,故答案为: ;
;
(3)由W、Y、Z、M四种元素组成的两种离子化合物硫酸氢铵、亚硫酸氢铵或亚硫酸铵,二者反应生成二氧化硫和水,离子方程式为SO32-+2H+=SO2↑+H2O 或 HSO3-+H+=SO2↑+H2O,故答案为:SO32-+2H+=SO2↑+H2O 或 HSO3-+H+=SO2↑+H2O;
(4)H2与O2反应生成化合物H2O,H2与Cl2反应生成化合物HCl,HCl和氧气反应生成水和氯气,每生成1molCl2放热56kJ,生成2mol氯气放出112kJ热量,所以其热化学反应方程式为2HCl(g)+
O2(g)=H2O(g)+Cl2(g)△H=-56 kJ/mol或4HCl(g)+O2(g)=2H2O(g)+2Cl2(g)△H=-112 kJ/mol,故答案为:2HCl(g)+
O2(g)=H2O(g)+Cl2(g)△H=-56 kJ/mol或4HCl(g)+O2(g)=2H2O(g)+2Cl2(g)△H=-112 kJ/mol;
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁,丙是CO、丁是NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊,根据化合价变化知,戊是CO2,根据反应物、生成物及反应条件知其反应方程式为2CO+2NO
N2+2CO2,该反应的平衡常数表达式为K=
,
故答案为:2CO+2NO
N2+2CO2;K=
;
①若气体体积较原来减少20%,说明气体的物质的量减少20%,混合气体减少的物质的量=(1+1)mol×20%=0.4mol,设参加反应的NO的物质的量为x,
2CO+2NO?N2+2CO2气体减少的物质的量
2mol 1mol
x 0.4mol
2mol:1mol=x:0.4mol
x=
=0.8mol,
则NO的转化率=
×100%=80%,
故答案为:80%;
②若仅将压强缩小为原来的一半,平衡向逆反应方向移动,混合气体每增大1mol,NO增大2mol,所以丁的体积分数变大,故答案为:变大.
X属于第二周期元素,则X为C元素,W是H或Li元素,根据(3)题知,W是H元素,根据元素在周期表中的位置知,M是S元素,Z与M的最低负化合价相同,且Z原子序数小于M,所以Z是O元素,Y元素原子序数大于X而小于Z,所以Y是N元素,Q属于短周期主族元素且原子序数大于M,所以Q是Cl元素,
(1)M原子核外有3个电子层、最外层电子数是6,则M位于第三周期第VIA族,故答案为:第三周期第VIA族;
(2)Y与W形成的6核分子为肼,每个N原子连接两个H原子,N原子之间共用一个电子对,其结构式为
 ,故答案为:
,故答案为: ;
;(3)由W、Y、Z、M四种元素组成的两种离子化合物硫酸氢铵、亚硫酸氢铵或亚硫酸铵,二者反应生成二氧化硫和水,离子方程式为SO32-+2H+=SO2↑+H2O 或 HSO3-+H+=SO2↑+H2O,故答案为:SO32-+2H+=SO2↑+H2O 或 HSO3-+H+=SO2↑+H2O;
(4)H2与O2反应生成化合物H2O,H2与Cl2反应生成化合物HCl,HCl和氧气反应生成水和氯气,每生成1molCl2放热56kJ,生成2mol氯气放出112kJ热量,所以其热化学反应方程式为2HCl(g)+
| 1 |
| 2 |
| 1 |
| 2 |
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁,丙是CO、丁是NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊,根据化合价变化知,戊是CO2,根据反应物、生成物及反应条件知其反应方程式为2CO+2NO
| 催化剂 |
| c2(CO2).c(N2) |
| c2(CO).c2(NO) |
故答案为:2CO+2NO
| 催化剂 |
| c2(CO2).c(N2) |
| c2(CO).c2(NO) |
①若气体体积较原来减少20%,说明气体的物质的量减少20%,混合气体减少的物质的量=(1+1)mol×20%=0.4mol,设参加反应的NO的物质的量为x,
2CO+2NO?N2+2CO2气体减少的物质的量
2mol 1mol
x 0.4mol
2mol:1mol=x:0.4mol
x=
| 0.4mol×2mol |
| 1mol |
则NO的转化率=
| 0.8mol |
| 1mol |
故答案为:80%;
②若仅将压强缩小为原来的一半,平衡向逆反应方向移动,混合气体每增大1mol,NO增大2mol,所以丁的体积分数变大,故答案为:变大.
点评:本题考查化学平衡的计算、热化学反应方程式的书写、离子方程式的书写等知识点,较综合,难点是化学平衡的计算,知道外界条件对化学平衡移动的影响,且为高考高频点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
已知元素R和Q的价电子排布如下,不能形成 RQ2型化合物的是( )
| A、2s22p2 和2s22p4 |
| B、3s23p4 和2s22p4 |
| C、3s2 和2s22p5 |
| D、3s1 和3s23p4 |
如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )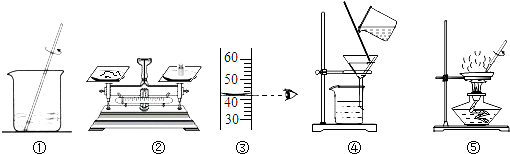

| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿包Cr3+.下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺檄性气味.
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺檄性气味.
| A、②④⑤ | B、②③ | C、①③ | D、①④ |
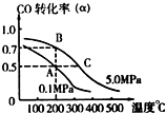 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究. 硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)