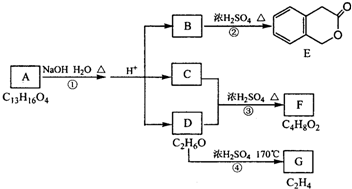
题目内容
已知元素R和Q的价电子排布如下,不能形成 RQ2型化合物的是( )
| A、2s22p2 和2s22p4 |
| B、3s23p4 和2s22p4 |
| C、3s2 和2s22p5 |
| D、3s1 和3s23p4 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据原子的价电子排布式确定元素种类,再根据元素种类确定形成化合物的类型.
解答:
解:A、价电子排布为2s22p2 和2s22p4,分别是C元素和O元素,可以形成CO2,故A错误;
B、价电子排布为3s23p4 和2s22p4,分别是S元素和O元素,可以形成SO2,故B错误;
C、价电子排布为3s2 和2s22p5,分别是Mg元素和F元素,可以形成MgF2,故C错误;
D、价电子排布为3s1 和3s23p4,分别是Na元素和S元素,可以形成Na2S,故D正确;
故选D.
B、价电子排布为3s23p4 和2s22p4,分别是S元素和O元素,可以形成SO2,故B错误;
C、价电子排布为3s2 和2s22p5,分别是Mg元素和F元素,可以形成MgF2,故C错误;
D、价电子排布为3s1 和3s23p4,分别是Na元素和S元素,可以形成Na2S,故D正确;
故选D.
点评:本题主要考查根据价电子排布式推断元素,难度不大,解题时注意元素化合物知识的应用.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
实验室用以下三种途径来制取相同质量的硝酸铜:从消耗原料和是否污染环境的角度,下列有关叙述不正确的是( )
①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
| A、所消耗的铜的质量相等 |
| B、所消耗的硝酸的量:②>①>③ |
| C、对环境造成的危害,③最小 |
| D、制取硝酸铜的最佳方案是③ |
镁铝合金5.1g溶于300mL 2mol?L-1盐酸中,标准状况下放出气体体积为5.6L,向反应后的溶液中加入500mL NaOH溶液充分反应,最终产生白色沉淀.下列有关说法不正确的是( )
| A、5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g |
| B、溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
| C、生成白色沉淀的最大质量为13.6 g |
| D、若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol?L-1 |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水.下列说法正确的是( )
| A、混合气体一定没有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中一定有乙烯 |
下列有关说法不正确的是( )
| A、石油分馏属物理变化,煤的干馏和石油裂化、裂解均属于化学变化 |
| B、豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定 |
| C、乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生红色沉淀 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |