题目内容
如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )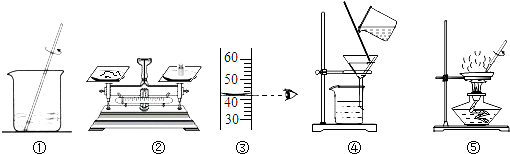

| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
考点:过滤、分离与注入溶液的仪器,蒸发、蒸馏与结晶的仪器,物质分离和提纯的方法和基本操作综合应用
专题:
分析:A.粗盐提纯中难溶性杂质的去除的操作步骤是溶解、过滤、蒸发,据此进行分析判断;
B.根据溶解、过滤、蒸发操作中的玻璃棒的作用进行分析判断;
C.量取的水为42g;
D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大.
B.根据溶解、过滤、蒸发操作中的玻璃棒的作用进行分析判断;
C.量取的水为42g;
D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大.
解答:
解:A.粗盐中难溶性杂质的去除的操作步骤是溶解、过滤、蒸发,即步骤是①④⑤,其中去除杂质的关键一步是过滤(把不溶于液体的固体与液体分离的一种方法),故A错误;
B.甲实验各步操作中,溶解时玻璃棒的作用是搅拌,能够加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体飞溅;玻璃棒的作用不相同,故B错误;
C.量取的水为42g,由溶质质量分数的公式可知,会导致配制的溶液浓度偏大,故C正确;
D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大,则会导致配制的溶液浓度偏小,故D错误.
故选C.
B.甲实验各步操作中,溶解时玻璃棒的作用是搅拌,能够加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体飞溅;玻璃棒的作用不相同,故B错误;
C.量取的水为42g,由溶质质量分数的公式可知,会导致配制的溶液浓度偏大,故C正确;
D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大,则会导致配制的溶液浓度偏小,故D错误.
故选C.
点评:本题考查化学实验基本操作,难度不大,掌握粗盐提纯的步骤与注意事项、配制一定质量分数的溶液的步骤与注意事项是正确解答本题的关键.

练习册系列答案
相关题目
如图所示与对应的叙述相符的是( )


| A、甲图表示可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)增大压强后,V正、V逆变化图 |
| B、乙图是标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化图.由图可知ab段反应是:SO2+2H2S═3S↓+2H2O |
| C、丙图表明合成氨反应温度与转化率之间的关系,由图知合成氨反应是吸热反应 |
| D、丁图表明向一定量的NaOH溶液中逐滴加入AlCl3溶液的反应.说明反应分两步:①Al3++3OH-=Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水.下列说法正确的是( )
| A、混合气体一定没有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中一定有乙烯 |
下列关于有机物的叙述正确的是( )
| A、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| D、用氢氧化钠溶液可除去乙酸乙酯中混有的少量的乙酸 |
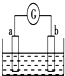 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )| A、a为负极,是铁片,烧杯中的溶液为稀硫酸 |
| B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C、a为正极,是碳棒,烧杯中的溶液为稀硫酸 |
| D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
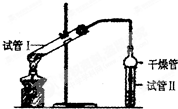 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
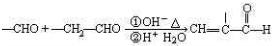
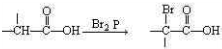
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.