题目内容
11.化学与生产、生活密切相关.下列有关说法不正确的是( )| A. | 浓硫酸可作干燥剂 | B. | SO2可作食品的漂白剂 | ||
| C. | 漂白液可作环境的消毒剂 | D. | KAl(SO4)2•12H2O可作净水剂 |
分析 A.浓硫酸具有吸水性;
B.二氧化硫有毒;
C.漂白液具有强氧化性,能杀菌消毒;
D.明矾在溶液中电离出铝离子,会水解生成具有吸附作用的物质.
解答 解:A.浓硫酸具有吸水性,可以用作干燥剂,故A正确;
B.二氧化硫有毒,不能用于食品漂白,故B错误;
C.漂白液具有强氧化性,能杀菌消毒,所以漂白液可作环境的消毒剂,故C正确;
D.明矾在溶液中电离出铝离子,铝离子在溶液中水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附作用,能吸附水中的悬浮颗粒,从而起到净水作用,故D正确.
故选B.
点评 本题考查了化学知识在生产生活中的应用,题目涉及干燥剂、二氧化硫的性质和应用、漂白液、明矾净水等,侧重于考查学生对基础知识的应用能力,题目难度不大.

练习册系列答案
相关题目
2.下列反应的产物可使酸性高锰酸钾溶液褪色的是( )
| A. | 丙烯的加聚反应产物 | |
| B. | 乙醇的消去反应产物 | |
| C. | 甲烷与氯气的取代反应中的有机产物 | |
| D. | 苯与氢气按1:3加成反应的产物 |
6.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2.某小组设计了如图实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.回答下列问题:
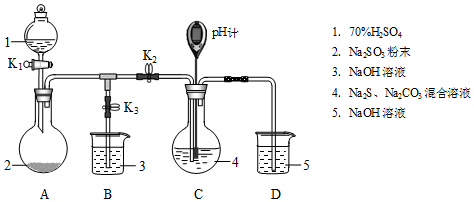
(1)装置A的作用是制备SO2,反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4.
(2)完成表实验过程:
(3)Na2S2O3有还原性,可作脱氯剂.向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成.

(1)装置A的作用是制备SO2,反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4.
(2)完成表实验过程:
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): S2-+H2O?HS-+OH- |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少); ⅱ.pH计读数逐渐 减小 | 反应分步进行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3 | / | 必须立即停止通SO2的原因是: SO2过量会使溶液酸度增加,使产物分解,降低产率 |
16.下列现象中硫酸表现出既有氧化性又有酸性的是( )
| A. | 铜与浓硫酸共热有气体放出 | |
| B. | 用玻璃棒蘸浓硫酸滴在白纸上,白纸变黑 | |
| C. | 把木炭放入热的浓硫酸中,有气体放出 | |
| D. | 常温下可用铁、铝制容器盛装冷的浓硫酸 |
3.根据下列实验操作和现象所得出的结论错误的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多空的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液. | 溶液变成棕黄色,一段时间后,溶液中有气泡出现,随后有红褐色沉淀生成. | Fe2+催化H2O2分解产生O2; H2O2分解反应放热,促进Fe3+的水解平衡正向移动. |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3 溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
20.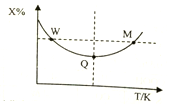 在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
 在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时,X的转化率大于Y的转化率 |
1.下列说法不正确的是( )
| A. | 芳香烃的获取主要来自煤的干馏和对石油分馏产品的催化重整 | |
| B. | 正丁烷转化为异丁烷一定有能量变化 | |
| C. | 石油的催化裂化主要目的是提高轻质液体燃料的产量尤其是汽油的产量 | |
| D. | 石油的常压分馏能得到润滑油、石蜡等 |