题目内容
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是( )
| A、锌是负极、铜是正极 |
| B、电子从铜片经导线流向锌片 |
| C、负极的反应式为2H++2e-═H2↑ |
| D、反应一段时间后,溶液的pH升高 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,以此解答.
解答:
解:A、锌比铜活泼,应为原电池的负极,发生氧化反应,铜为正极,发生还原反应,则A正确;
B、电子从负极流向正极,则电子从锌片经导线流向铜片,故B错误;
C、锌为负极,发生氧化反应,负极的反应式为Zn-2e-═Zn2+,故C错误;
D、正极上氢离子得电子发生还原反应,则氢离子浓度减小,所以溶液的pH升高,故D正确.
故选AD.
B、电子从负极流向正极,则电子从锌片经导线流向铜片,故B错误;
C、锌为负极,发生氧化反应,负极的反应式为Zn-2e-═Zn2+,故C错误;
D、正极上氢离子得电子发生还原反应,则氢离子浓度减小,所以溶液的pH升高,故D正确.
故选AD.
点评:本题考查原电池池知识,侧重于学生的分析能力和电化学知识的综合考查,注意把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
某短周期元素原子最外层只有2个电子,则该元素( )
| A、一定是第ⅡA族元素 |
| B、一定是金属元素 |
| C、一定是化合物中呈+2价元素 |
| D、可能是金属元素,也可能是非金属元素 |
据《自然》杂志报道,在300~400℃的高温下,将砂糖(主要成分为蔗糖)等碳水化合物用加热的方法使其形成焦糖与碳之间的“半成品碳”状态,再放进硫酸溶液中高温加热,生成了一种叫“焦糖烯”的物质,其分子式为C36H50O25.下列有关说法正确的是( )
| A、“半成品碳”在硫酸溶液中加热可能发生的是消去反应 |
| B、“半成品碳”是碳元素的一种新单质 |
| C、蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成 |
| D、焦糖烯是一种新型的烯烃 |
下列反应中属于取代反应的是( )
| A、苯与浓硝酸在浓硫酸作用下共热至50~60℃ |
| B、乙烯通入溴水中 |
| C、苯与氢气在催化剂作用下反应制得环己烷 |
| D、苯与溴水混合后,溴水层褪色 |
下列分析正确的是( )
| A、将氯气通入H2O2和NaOH的混合溶液中,发出红光,说明反应物的总能量低于生成物的总能量,放出热量 |
| B、1mol H2在氯气中完全燃烧,放出180kJ热量,则键能(E)的关系为E(H-H)=180kJ+2E(H-Cl)-E(Cl-Cl) |
| C、干燥的碘粉与铝粉混合无明显现象,滴上一滴水会冉冉升起紫色的碘蒸气,最后得到白色AlI3.说明碘和铝发生的反应是放热反应 |
| D、精确实验测得H2O在常温下也能微弱电离:H2O?H++OH-,该过程是放热过程 |
下列含有非极性键的共价化合物是( )
| A、HCl |
| B、Na2O2 |
| C、CH3CH3(乙烷) |
| D、CH4 |
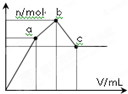 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
 请按要求完成下列各小题:
请按要求完成下列各小题: