题目内容
甲醇燃料电池的电解质溶液是KOH溶液.则通甲醇的电极反应式为 .若通空气的电极上有32g O2参加反应,则反应过程中转移了 mol e-.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:燃料电池中燃料在负极失电子发生氧化反应,碱溶液中生成碳酸钾,氧气在正极得到电子生成氢氧根离子.
解答:
解:甲醇-空气燃料电池中燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,C的化合价有-2价变为+4价,每摩C转移6摩电子,依据电荷守恒和原子守恒,写出电极反应式,电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,氧气在正极得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-,32g氧气为1mol,有1mol氧气反应转移电子物质的量为4mol,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;4.
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;4.
点评:本题考查了燃料电池中电极反应式书写和电子转移的计算,题目难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列说法错误的是( )
| A、对废旧金属的最好处理方法是回收、再用 |
| B、提炼金属要经过矿石的富集、冶炼、精炼三步 |
| C、活泼金属的冶炼都是通过电解其盐溶液 |
| D、热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等 |
下列有机反应方程式书写正确的是( )
A、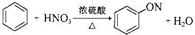 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|
利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )


| A、利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 |
| B、利尿酸分子与足量消耗氢氧化钠反应最多3mol |
| C、1 mol利尿酸能与7 mol H2发生加成反应 |
| D、利尿酸能与FeCl3溶液发生显色反应 |
钠与水反应的离子方程式正确的是( )
| A、2Na+3H+═2Na++H2↑ |
| B、Na+H2O═Na++OH-+H2↑ |
| C、2Na+2H2O═2Na++2OH-+H2↑ |
| D、2Na+2H2O═2Na++O2↑+2H2↑ |
下列说法不正确的是( )
| A、钠是电和热的良导体 |
| B、钠在空气中燃烧生成氧化钠,并发出黄色火焰 |
| C、钠与硫化合时可以发生爆炸 |
| D、钠离子半径比钠原子半径大 |
下列有关托盘天平的叙述,不正确的是 ( )
| A、称量前先调节托盘天平的零点 |
| B、称量时左盘放被称量物,右盘放砝码 |
| C、潮湿的或具有腐蚀性药品必须放在玻璃器皿中称量,其他固体药品可直接放在天平托盘上称量 |
| D、称量完毕,应把砝码放回砝码盒中 |
| E、用托盘天平可称准到0.01g |
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是( )
| A、锌是负极、铜是正极 |
| B、电子从铜片经导线流向锌片 |
| C、负极的反应式为2H++2e-═H2↑ |
| D、反应一段时间后,溶液的pH升高 |