题目内容
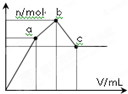 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
考点:离子方程式的有关计算
专题:计算题
分析:100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.(b到c)
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.(b到c)
解答:
解:100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.
A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,溶液的溶质是(NH4)2SO4,那么该物质水解溶液呈酸性溶液显示中性,故A错误;
B、由分析可知,b点发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,故B错误;
C、由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以
=0.25L=250ml,故C错误.
D、由分析可知,c为溶液为氨水与偏铝酸钡溶液,所以溶液呈碱性,故D正确;
故选:D.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.
A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,溶液的溶质是(NH4)2SO4,那么该物质水解溶液呈酸性溶液显示中性,故A错误;
B、由分析可知,b点发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,故B错误;
C、由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以
| 0.025mol |
| 0.1mol/L |
D、由分析可知,c为溶液为氨水与偏铝酸钡溶液,所以溶液呈碱性,故D正确;
故选:D.
点评:考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是( )
| A、锌是负极、铜是正极 |
| B、电子从铜片经导线流向锌片 |
| C、负极的反应式为2H++2e-═H2↑ |
| D、反应一段时间后,溶液的pH升高 |
下列说法正确的是( )
| A、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| B、不含金属元素的化合物也可能是离子化合物 |
| C、变价金属一定是过渡元素 |
| D、显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示: 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: