题目内容
 请按要求完成下列各小题:
请按要求完成下列各小题:(1)合成氨反应N2 (g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
(2)已知甲烷在高温下与水蒸气反应生成CO和H2.现有部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=a kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=b kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=c kJ/mol
请写出甲烷和水蒸气在高温下反应的热化学方程式
(3)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
若HA为HCN,该溶液显碱性,则溶液中c(CN-)
(4)在25℃时,将c mol?L-1的醋酸溶液与b mol?L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=
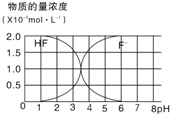
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F-)与溶液pH的变化关系如图.若将4.0×10-4mol?L-1CaCl2溶液与4.0×10-3mol?L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10]
.
考点:化学平衡的影响因素,用盖斯定律进行有关反应热的计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)恒温、恒压条件下向平衡体系中通入氩气,容器体积增大,反应各组分的浓度减小,等效为降低压强,平衡向气体体积增大的方向移动;
反应热只与始态与状态有关,使用催化剂降低活化能,不影响反应的始态与终态,反应热不变;
(2)写出水液化的热化学方程式,利用盖斯定律书写;
(3)从溶液电中性的角度比较离子浓度大小;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,以此计算;
(5)据浓度熵和沉淀的溶度积比较可知.
反应热只与始态与状态有关,使用催化剂降低活化能,不影响反应的始态与终态,反应热不变;
(2)写出水液化的热化学方程式,利用盖斯定律书写;
(3)从溶液电中性的角度比较离子浓度大小;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,以此计算;
(5)据浓度熵和沉淀的溶度积比较可知.
解答:
解:(1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动,该反应正反应是体积减小的反应,故平衡向左移动.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:向左;不变;
(2)已知:①2H2(g)+O2(g)=2H2O(l)△H=akJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=bkJ?mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=ckJ?mol-1
利用盖斯定律,③×2-①×3-②得:2CH4(g)+2H2O(g)=2CO(g)+6H2(g)△H=(2c-3a-b) kJ?mol-1,
故答案为:2CH4(g)+2H2O(g)=2CO(g)+6H2(g)△H=(2c-3a-b) kJ?mol-1;
(3)该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),则c(Na+)>c(CN-),
故答案为:<;因为c(Na+)+c(H+)=C(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,所以用含c的代数式表示CH3COOH的电离常数Ka=
=
mol?L-1,故答案为:
mol?L-1;
(5)根据图知,当pH=4时,溶液中c(F-)=1.6×10-3mol/L,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成,
故答案为:当pH=4时,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:向左;不变;
(2)已知:①2H2(g)+O2(g)=2H2O(l)△H=akJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=bkJ?mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=ckJ?mol-1
利用盖斯定律,③×2-①×3-②得:2CH4(g)+2H2O(g)=2CO(g)+6H2(g)△H=(2c-3a-b) kJ?mol-1,
故答案为:2CH4(g)+2H2O(g)=2CO(g)+6H2(g)△H=(2c-3a-b) kJ?mol-1;
(3)该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),则c(Na+)>c(CN-),
故答案为:<;因为c(Na+)+c(H+)=C(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,所以用含c的代数式表示CH3COOH的电离常数Ka=
10-7×
| ||||
|
| b×10-7 |
| c-b |
| b×10-7 |
| c-b |
(5)根据图知,当pH=4时,溶液中c(F-)=1.6×10-3mol/L,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成,
故答案为:当pH=4时,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
点评:题目综合性较大,涉及化学平衡影响因素及计算、盖斯定律、溶度积、电离平衡常数计算等,是对学生综合运用知识分析解决问题能力的考查,题目难度较大.

练习册系列答案
相关题目
下列有机反应方程式书写正确的是( )
A、 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|
下列说法不正确的是( )
| A、钠是电和热的良导体 |
| B、钠在空气中燃烧生成氧化钠,并发出黄色火焰 |
| C、钠与硫化合时可以发生爆炸 |
| D、钠离子半径比钠原子半径大 |
下列有关托盘天平的叙述,不正确的是 ( )
| A、称量前先调节托盘天平的零点 |
| B、称量时左盘放被称量物,右盘放砝码 |
| C、潮湿的或具有腐蚀性药品必须放在玻璃器皿中称量,其他固体药品可直接放在天平托盘上称量 |
| D、称量完毕,应把砝码放回砝码盒中 |
| E、用托盘天平可称准到0.01g |
下列不能用勒夏特列原理解释的事实是( )
| A、棕红色的NO2加压后颜色先变深后变浅 |
| B、氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C、黄绿色的氯水光照后颜色变浅 |
| D、合成氨工业使用高压以提高氨的产量 |
用坩埚钳夹住一片刚刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,可观察到熔化的铝并不滴落.对此现象解释不正确的是( )
| A、铝在空气中能很快形成氧化膜 |
| B、氧化膜的熔点比铝高 |
| C、氧化膜与盐酸不反应 |
| D、外焰温度未达到氧化膜的熔点 |
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是( )
| A、锌是负极、铜是正极 |
| B、电子从铜片经导线流向锌片 |
| C、负极的反应式为2H++2e-═H2↑ |
| D、反应一段时间后,溶液的pH升高 |
下列说法正确的是( )
| A、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| B、不含金属元素的化合物也可能是离子化合物 |
| C、变价金属一定是过渡元素 |
| D、显酸性的溶液中溶质只能是酸或强酸弱碱盐 |