题目内容
1.已知:①CH4(g)+2O2(g)→CO2(g)+2H2O(g)△H=-Q1kJ/mol;②2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
③H2O(g)═H2O(l)△H=-Q3 kJ/mol
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,根据体积比较计算甲烷、氢气的物质的量,再根据热化学方程式计算燃烧放出的热量,注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答 解:标准状况下,112L甲烷和氢气混合气体的物质的量为$\frac{112L}{22.4L/mol}$=5mol,甲烷和氢气的体积之比为4:1,所以甲烷的物质的量为:5mol×$\frac{4}{5}$=4mol,氢气的物质的量为5mol-4mol=1mol,
由①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q1;
②2H2(g)+O2(g)=2H2O(g)△H=-Q2
③H2O(g)=H2O(l)△H=-Q3
根据盖斯定律①+③×2可得,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-(Q1+2Q3),
根据盖斯定律②+③×2可得,2H2(g)+O2(g)=2H2O(l)△H=-(Q2+2Q3),
4mol甲烷燃烧放出的热量为4×(Q1+2Q3)kJ,1mol氢气燃烧放出的热量为1×0.5×(Q2+2Q3),
所以放出的热量为4×(Q1+2Q3)+1×0.5×(Q2+2Q3)=4Q1+0.5Q2+9Q3kJ,
故选:D.
点评 本题考查根据热化学方程式计算反应热,难度不大,注意根据水的状态选择相应的热化学方程式计算反应热.

练习册系列答案
相关题目
11.下列关于糖类、油脂、蛋白质的说法不正确的是( )
| A. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| B. | 可用浓硝酸鉴别含苯环的蛋白质 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 淀粉水解与纤维素水解得到的最终产物相同 |
12.下列有关说法正确的是( )
| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 反应CaSO4(s)+CO32-(aq)?CaCO3 (s)+SO42-(aq) 的实质就是沉淀溶解平衡的移动 |
9.下列物质属于酸性氧化物的是( )
| A. | CO | B. | K2SO4 | C. | SO2 | D. | Na20 |
6.在恒温条件下,体积固定的密闭容器中,进行可逆反应A(s)+3B(g)?3C(g),下列不能说明可逆反应达到平衡状态的是( )
| A. | B的浓度不再变化 | |
| B. | 混合气体的压强不再变化 | |
| C. | 混合气体的密度不再变化 | |
| D. | 混合气体的平均相对分子质量不再改变 |
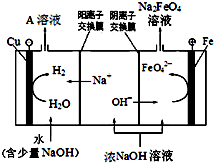 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.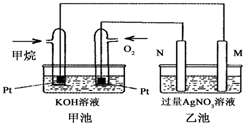 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题: