题目内容
16.写出下列物质在水中的电离方程式:硫酸铁Fe2(SO4)3Fe2(SO4)3=2Fe3++3SO42-氯化铜CuCl2=Cu2++2Cl-.分析 硫酸铁为强电解质,完全电离,用等号;
氯化铜为强电解质,完全电离,用等号;
解答 解:硫酸铁为强电解质,完全电离,电离方程式:Fe2(SO4)3=2Fe3++3SO42-;
氯化铜为强电解质,完全电离,电离方程式:CuCl2=Cu2++2Cl-;
故答案为:Fe2(SO4)3=2Fe3++3SO42-;CuCl2=Cu2++2Cl-;
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
6.下列有关化学用语使用不正确的是( )
| A. | 羟基的电子式: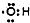 | |
| B. | 苯的分子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 甲烷分子的比例模型: |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、CH3COO-、NO3- | |
| D. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Ba2+、K+、Cl-、HCO3- |
4.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L 和2mol/L,取10mL此混合酸,向其中加入足量的铜粉,待反应结束后,可产生标准状况下的气体为( )
| A. | 2.24 L | B. | 1.12 L | C. | 0.672 L | D. | 0.448 L |
11.下列溶液中溶质的物质的量浓度为1 mol•L-1的是( )
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 在1L 0.5 mol/L的盐酸加入1.5 mol/L盐酸1L | |
| D. | 从1000mL 1mol/LNaCl溶液中取出100mL的溶液 |
1.已知:①CH4(g)+2O2(g)→CO2(g)+2H2O(g)△H=-Q1kJ/mol;
②2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
③H2O(g)═H2O(l)△H=-Q3 kJ/mol
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
②2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
③H2O(g)═H2O(l)△H=-Q3 kJ/mol
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
8.在0.1mol•L-1NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
5.关于下列装置的说法中正确的是( )
| A. | 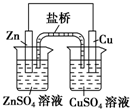 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 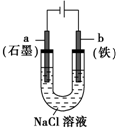 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 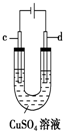 用装置精炼铜时,c极为粗铜 | |
| D. | 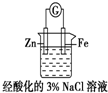 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
6. 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |