题目内容
13.表是元素周期表的一部分,其中列出10种元素在周期表中的位置.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)这10种元素中,化学性质最不活泼的是Ar.
(2)这些元素的最高价氧化物对应的水化物中,最强酸与最强碱生成的盐是KClO4.
(3)②、③和④3种元素所形成简单离子的半径大小次序是K+>Ca2+>Mg2+.
(4)⑦元素氢化物在常温下跟②发生反应的离子方程式是2K+2H2O=2K++2OH-+H2↑.
(5)用电子式表示⑨与①元素形成化合物的过程
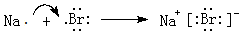 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.(6)⑧元素和⑨元素两者的核电荷数之差是18,试举例说明⑧单质的氧化性比⑨单质强(用化学方程式表示)2KBr+Cl2=2KCl+Br2.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)最高价氧化物对应的水化物中,最强酸为高氯酸,最强碱为KOH;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多,离子半径越大;
(4)K与水反应生成氢氧化钾与氢气;
(5)⑨与①元素形成化合物为NaBr,属于离子化合物,Na元素焰色反应为黄色;
(6)⑧元素和⑨元素的核电荷数之差为的第四周期容纳元素种数;利用单质之间相互酯化反应说明⑧单质的氧化性比⑨单质强.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar.
(1)稀有气体Ar原子最外层为稳定结构,不容易失去电子,也不容易获得电子,化学性质最不活泼,
故答案为:Ar;
(2)最高价氧化物对应的水化物中,最强酸为高氯酸,最强碱为KOH,二者反应生成的盐为KClO4,
故答案为:KClO4;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:K+>Ca2+>Mg2+,
故答案为:K+>Ca2+>Mg2+;
(4)⑦元素氢化物在常温下跟②发生反应,是K与水反应生成氢氧化钾与氢气,反应的离子方程式是:2K+2H2O=2K++2OH-+H2↑,
故答案为:2K+2H2O=2K++2OH-+H2↑;
(5)⑨与①元素形成化合物为NaBr,属于离子化合物,用电子式表示其形成过程为: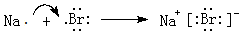 ,含有Na元素,其焰色反应为黄色,
,含有Na元素,其焰色反应为黄色,
故答案为: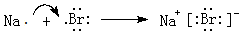 ;黄色;
;黄色;
(6)⑧元素和⑨元素为VIA族相邻元素,二者核电荷数之差为的第四周期容纳元素种数,即相差18,说明⑧单质的氧化性比⑨单质强的化学方程式为:2KBr+Cl2=2KCl+Br2,
故答案为:18;2KBr+Cl2=2KCl+Br2.
点评 本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期表的结构,理解掌握元素周期律,掌握用电子式表示物质或化学键的形成.

| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
| A. | 该化学反应的过程是吸热的 | |
| B. | 该化学反应的过程是放热的 | |
| C. | 分子运动速率加快,使反应物分子的碰撞机会增多 | |
| D. | 反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多 |
| A. | 固体碳酸钠 | B. | 食醋 | C. | 白酒 | D. | 白糖 |
| A. | 等于25% | B. | 大于25% | C. | 小于25% | D. | 无法确定 |
| A. | S(g)<S(1)<S(s) | B. | S(g)>S(1)>S(s) | C. | S(g)>S(1)=S(s) | D. | S(g)>S(s)>S(1) |
 H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).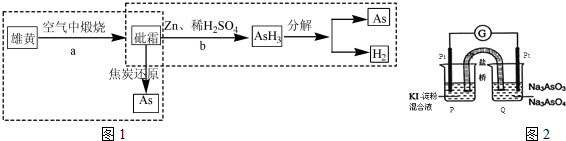
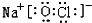 .
.