题目内容
5.为了防治病虫害,农民常对生长过程中的蔬菜喷洒农药.据有关专家介绍,用碱性溶液或清水浸泡冲洗蔬菜,可使残留在蔬菜上的农药毒性降低.因此,买来的蔬菜在食用前可用稀碱水或清水浸泡一段时间.则浸泡蔬菜时可加入适量的( )| A. | 固体碳酸钠 | B. | 食醋 | C. | 白酒 | D. | 白糖 |
分析 由信息知用清水,特别是碱性溶液浸泡冲洗蔬菜,可使残留在蔬菜上的农药毒性降低.因此浸泡蔬菜时最好加入适量的碱性溶液,由此分析解答.
解答 解:从四个选项中找出显碱性的物质就是本题答案.
A、纯碱显碱性,故A正确;
B、食醋显酸性,故B错误;
C、白酒显中性,故C错误;
D、白糖显中性,故D错误.
故选A.
点评 本题考查溶液的酸碱性和习题信息处理,学生要熟悉生活中常见物质的溶液的酸碱性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.0.5L 1molL-1FeCl3溶液与0.1L 1molL-1MgCl2溶液中Cl-的数目之比( )
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
13.表是元素周期表的一部分,其中列出10种元素在周期表中的位置.
根据表回答下列问题(用元素符号或者相应的化学式表示):
(1)这10种元素中,化学性质最不活泼的是Ar.
(2)这些元素的最高价氧化物对应的水化物中,最强酸与最强碱生成的盐是KClO4.
(3)②、③和④3种元素所形成简单离子的半径大小次序是K+>Ca2+>Mg2+.
(4)⑦元素氢化物在常温下跟②发生反应的离子方程式是2K+2H2O=2K++2OH-+H2↑.
(5)用电子式表示⑨与①元素形成化合物的过程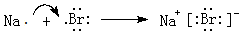 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.
(6)⑧元素和⑨元素两者的核电荷数之差是18,试举例说明⑧单质的氧化性比⑨单质强(用化学方程式表示)2KBr+Cl2=2KCl+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)这10种元素中,化学性质最不活泼的是Ar.
(2)这些元素的最高价氧化物对应的水化物中,最强酸与最强碱生成的盐是KClO4.
(3)②、③和④3种元素所形成简单离子的半径大小次序是K+>Ca2+>Mg2+.
(4)⑦元素氢化物在常温下跟②发生反应的离子方程式是2K+2H2O=2K++2OH-+H2↑.
(5)用电子式表示⑨与①元素形成化合物的过程
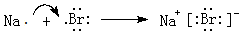 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.(6)⑧元素和⑨元素两者的核电荷数之差是18,试举例说明⑧单质的氧化性比⑨单质强(用化学方程式表示)2KBr+Cl2=2KCl+Br2.
20.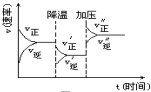 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |
10.通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),已知
则下列热化学方程式不正确的是( )
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 2HCl(g)═H2(g)+Cl2(g)△H=183 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=91.5 kJ•mol-1 |
14.在指定环境中,下列各组离子一定可以大量共存的是( )
| A. | 使pH试纸呈红色的溶液:I-、NO3-、SO42-、Na+ | |
| B. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| C. | 加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3- | |
| D. | 使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、Al3+ |
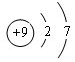 .
.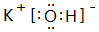 ;其中所含化学键的类型离子键、共价键.
;其中所含化学键的类型离子键、共价键.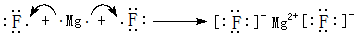 .
.