题目内容
2.密度为0.91g/cm3的氨水,质量分数为50%,该氨水用等体积的水稀释后,所得溶液里溶质的质量分数为( )| A. | 等于25% | B. | 大于25% | C. | 小于25% | D. | 无法确定 |
分析 设浓氨水的体积为V,稀释前后溶液中溶质的质量不变,氨水的密度小于水的密度,浓度越大密度越小,稀释后得到氨水的密度应大于0.91g•cm-3,据此解答.
解答 解:设浓氨水的体积为V,密度为ρ浓,稀释后密度为ρ稀,稀释前后溶液中溶质的质量不变,则:稀释后质量分数ω=$\frac{ρ浓×V×50%}{2Vρ稀}$,氨水的密度小于水的密度,浓度越大密度越小,所以ρ浓<ρ稀,所以$\frac{ρ浓×V×50%}{2Vρ稀}$<25%,
故选:C.
点评 本题考查了溶液稀释后质量分数计算,明确氨水密度小于水、稀释前后溶质的质量不变是解题关键,题目难度中等.

练习册系列答案
相关题目
12.如图所示实验操作不正确的是( )
| A. |  倾倒液体 | B. |  检查气密性 | C. |  稀释浓硫酸 | D. |  取用固体 |
13.表是元素周期表的一部分,其中列出10种元素在周期表中的位置.
根据表回答下列问题(用元素符号或者相应的化学式表示):
(1)这10种元素中,化学性质最不活泼的是Ar.
(2)这些元素的最高价氧化物对应的水化物中,最强酸与最强碱生成的盐是KClO4.
(3)②、③和④3种元素所形成简单离子的半径大小次序是K+>Ca2+>Mg2+.
(4)⑦元素氢化物在常温下跟②发生反应的离子方程式是2K+2H2O=2K++2OH-+H2↑.
(5)用电子式表示⑨与①元素形成化合物的过程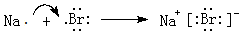 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.
(6)⑧元素和⑨元素两者的核电荷数之差是18,试举例说明⑧单质的氧化性比⑨单质强(用化学方程式表示)2KBr+Cl2=2KCl+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)这10种元素中,化学性质最不活泼的是Ar.
(2)这些元素的最高价氧化物对应的水化物中,最强酸与最强碱生成的盐是KClO4.
(3)②、③和④3种元素所形成简单离子的半径大小次序是K+>Ca2+>Mg2+.
(4)⑦元素氢化物在常温下跟②发生反应的离子方程式是2K+2H2O=2K++2OH-+H2↑.
(5)用电子式表示⑨与①元素形成化合物的过程
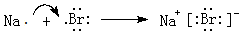 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.(6)⑧元素和⑨元素两者的核电荷数之差是18,试举例说明⑧单质的氧化性比⑨单质强(用化学方程式表示)2KBr+Cl2=2KCl+Br2.
10.通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),已知
则下列热化学方程式不正确的是( )
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 2HCl(g)═H2(g)+Cl2(g)△H=183 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=91.5 kJ•mol-1 |
14.在指定环境中,下列各组离子一定可以大量共存的是( )
| A. | 使pH试纸呈红色的溶液:I-、NO3-、SO42-、Na+ | |
| B. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| C. | 加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3- | |
| D. | 使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、Al3+ |
11.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的是( )
| A. | 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 | |
| B. | 分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 | |
| C. | 分别配成溶液,加入澄清石灰水,比较是否有沉淀生成 | |
| D. | 分别将等质量的白色粉末加热,将产生的气体通入澄清石灰水中看是否变浑浊 |
12.下列说法正确的是( )
| A. | 碘升华时需要克服分子间作用力,不破坏共价键 | |
| B. | NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键 | |
| C. | 干冰和水分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物在任何状态下都能导电 |