题目内容
2.判断下列元素中不属于主族元素的是( )| A. | 铁 | B. | 钠 | C. | 磷 | D. | 氯 |
分析 熟记常见元素在周期表中的位置,根据元素周期表的结构来判断元素所属的周期和族.
解答 解:A、金属铁属于ⅤⅢ族元素,不属于主族元素,故A选;
B、钠元素在第ⅠA,属于主族元素,故B不选;
C、磷元素在第ⅤA,属于主族元素,故C不选;
D、氯元素在第ⅤⅡA,属于主族元素,故D不选.
故选A.
点评 本题考查学生元素在周期表中的位置以及周期和族的分布知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1).下列有关元素X的说法中正确的是( )
| A. | X可能是金属元素 | |
| B. | 由X形成的含氧酸均为强酸 | |
| C. | X不能形成化学式为KXO4的含氧酸盐 | |
| D. | 元素X的气态氢化物一定极易溶于水 |
4.下列有关叙述正确的是( )
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 甲苯(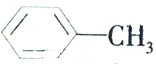 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 |
10. 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是: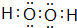 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
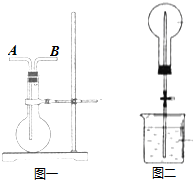
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是:
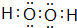 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
17.据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20.下列叙述正确的是( )
| A. | 10B20为硼元素的一种原子 | B. | 10B20为硼元素的一种单质 | ||
| C. | 10B的中子数比核外电子数多 | D. | 10B的原子核外电子排布为 |
7.甲、乙两个研究性学习小组拟从实验室含碘废液中回收碘.制订两种方案提取,他们的实验方案如下:
(甲小组实施的为方案一,乙小组实施的为方案二)
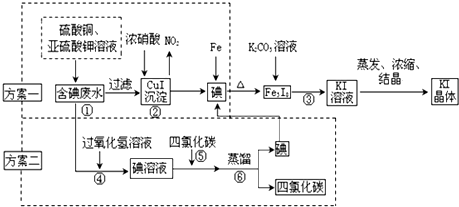
I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
①在进行步骤四前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液自身可作指示剂.
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
(甲小组实施的为方案一,乙小组实施的为方案二)

I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
14.下列说法不正确的是( )
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
11.将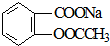 转变为
转变为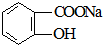 的方法为( )
的方法为( )
 转变为
转变为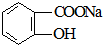 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
12.类比推理是化学学习中的一种重要方法.下列类推结论正确的是( )
| 选项 | 类比对象 | 结论 |
| A | 2F2+2H2O═4HF+O2 | 2I2+H2O═4HI+O2↑ |
| B | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | 3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ |
| C | Na2O+H2O═2NaOH | FeO+H2O═Fe(OH)2 |
| D | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |