题目内容
12.相等物质的量的下列物质,分别与足量NaOH溶液反应,消耗NaOH物质的量最多的是( )| A. | AlCl3 | B. | Al2O3 | C. | Al(OH)3 | D. | Al |
分析 令各物质的物质的量为1mol,根据方程式计算,
A.AlCl3与氢氧化钠反应为Al3++4OH-=AlO2-+2H2O;
B.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+2H2O;
C.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=2NaAlO2+2H2O;
D.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2.
解答 解:令各物质的物质的量为1mol
A.AlCl3与氢氧化钠反应为Al3++4OH-=AlO2-+H2O,由方程式可知1molAlCl3消耗NaOH的物质的量为4mol;
B.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,由方程式可知1molAl2O3消耗NaOH的物质的量为2mol;
C.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=2NaAlO2+2H2O,由方程式可知1molAl(OH)3消耗NaOH的物质的量为1mol;
D.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知1molAl消耗NaOH的物质的量为1mol;
相同物质的量的四种物质,AlCl3消耗NaOH最多.
故选:A.
点评 本题考查铝及其化合物的性质,主要是反应的定量关系分析判断,难度不大,注意基础知识的掌握,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
3.下列说法正确的是( )
| A. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Ksp均增大 | |
| C. | 25℃时pH=11的NaOH,当温度升高到80℃时,其pH不变 | |
| D. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明CH3COOH 是弱电解质 |
20.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2氧化能力相近,二者互为同位素 | |
| B. | .过氧化氢的电子式: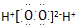 | |
| C. | .同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | .同周期主族元素原子半径随核电荷数的增大而减小 |
7.下列离子方程式书写正确的是( )
| A. | Ba(OH)2溶液中加入少量NaHSO4:OH-+H+═H2O | |
| B. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | NaOH溶液中通入足量的CO2:OH-+CO2═HCO3- | |
| D. | Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | S2和S8的混合物共6.4 g,所含硫原子数一定为0.2NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| C. | 在反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3 mol Cl2,转移的电子数为6NA | |
| D. | 将含有1 mol Na2CO3的溶液逐滴加入到含1.5 mol HCl的溶液中,产生气体的分子数目为0.5NA |
4.在自然界中只能以化合态存在的元素是( )
| A. | 氮 | B. | 氯 | C. | 硫 | D. | 碳 |
1. 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是0.0035mol/(L•min).
(2)该温度下,该反应的化学平衡常数是0.053(保留两位有效数字).
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.
 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是0.053(保留两位有效数字).
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.
1.X、Y、Z、W为原子序数依次增大的短周期非金属元素,且四种元素分别位于四个连续的主族中,Z元素的核电荷数为X元素的2倍.下列说法错误的是( )
| A. | 气态氢化物的稳定性:W>Z | |
| B. | 简单离子半径:X<Y | |
| C. | 液态ZW4气化需克服分子间作用力 | |
| D. | X、W可以同时出现在同一离子化合物中 |
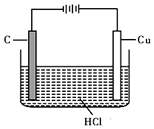 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.