题目内容
2. 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.(1)通常条件下,铜与稀盐酸不反应.但在如下两种情况下能发生:
①向稀盐酸中加入H2O2后,铜发生溶解.写出此反应的化学方程式:Cu+H2O2+2HCl═CuCl2+2H2O;
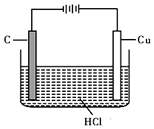
②如图,阳极的反应式Cu-2e-═Cu2+,
总反应的化学方程式是Cu+2HCl$\frac{\underline{\;通电\;}}{\;}$CuCl2+H2↑
(2)写出铜和浓硝酸反应的化学方程式:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(3)在一定体积的18mol/L的浓硫酸中加入过量的铜片,加热使之反应,化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2(g)↑,若被还原的硫酸是0.9mol,则消耗此浓硫酸的实际体积大于100mL(填“大于”或“小于”).
分析 (1)①双氧水具有氧化性,在酸性环境下能将金属铜氧化;
②用电解原理实现铜和盐酸的反应,铜应作电解池的阳极,为活性电极,发生氧化反应;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水;
(3)铜只能和浓硫酸反应,而与稀硫酸不反应,由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则18mol•L-1的浓硫酸的实际体积要大于理论计算值,以此来解答.
解答 解:(1)①双氧水具有氧化性,在酸性环境下能将金属铜氧化,反应的化学方程式Cu+H2O2+2HCl═CuCl2+2H2O,
故答案为:Cu+H2O2+2HCl═CuCl2+2H2O;
②因铜与盐酸不反应,可用电解的方法完成,电解时,Cu作阳极,发生Cu-2e-═Cu2+,阴极上生成氢气,反应的总反应式为Cu+2HCl$\frac{\underline{\;通电\;}}{\;}$CuCl2+H2↑,
故答案为:Cu-2e-═Cu2+;Cu+2HCl$\frac{\underline{\;通电\;}}{\;}$CuCl2+H2↑;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(3)只能和浓硫酸反应,而与稀硫酸不反应,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则
由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,
2 1
1.8mol 0.9mol
理论消耗浓硫酸为$\frac{1.8mol}{18mol/L}$=0.1L=100mL,铜只能和浓硫酸反应,而与稀硫酸不反应,则实际体积大于100mL,
故答案为:大于.
点评 本题考查了三大强酸的性质,涉及方程式的书写、电极反应式的书写、有关方程式的计算,明确浓硫酸、浓硝酸的强氧化性是解题关键,注意稀硫酸与Cu不反应,题目难度中等.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 1mol固态物质或液态物质的体积主要决定于构成这种物质的粒子的大小和粒子数目 | |
| B. | 在相同温度和压强下,任何气体粒子之间的距离可看成相等的 | |
| C. | 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 | |
| D. | 为与容量瓶的精度相匹配称量固体质量时不应用托盘天平 |
| A. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| B. | Na2O 和Na2O2都能与水反应生成碱,它们都是碱性氧化物 | |
| C. | 铝与氢氧化钠的反应中水和氢氧化钠均作氧化剂 | |
| D. | 铝箔在空气中受热可以熔化,且发生剧烈燃烧 |
①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
②2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | K+、Mg2+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.075 | 0.074 |
| 主要化合价 | +2 | +3 | +5,+3,-3 | -2 |
| A. | X.Y元素的金属性X>Y | B. | Z,W元素的非金属性Z>W | ||
| C. | Y,W形成的化合物具有两性 | D. | Z的氢化物为一种碱性气体 |
①增大反应物的浓度
②升高温度
③增大压强
④加入催化剂.
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ①③ |
| A. | AlCl3 | B. | Al2O3 | C. | Al(OH)3 | D. | Al |