题目内容
1. 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是0.053(保留两位有效数字).
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.
分析 (1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.26mol,减少了0.14mol,
C8H10(g)?C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
根据v=$\frac{△c}{△t}$计算;
(2)30min到40min时,n(C8H8)不再变化,说明30min时反应达到平衡状态,根据平衡常数计算公式计算,K=$\frac{c({C}_{8}{H}_{8})c({H}_{2})}{c({C}_{8}{H}_{10})}$;
(3)根据C8H10(g)?C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)?C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.26mol,减少了0.14mol,
C8H10(g)?C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=$\frac{\frac{0.14mol}{2L}}{20min}$=0.0035mol/(L•min)
故答案为:0.0035mol/(L•min);
(2)C8H10(g)?C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=$\frac{c({C}_{8}{H}_{8})c({H}_{2})}{c({C}_{8}{H}_{10})}$=$\frac{0.08×0.08}{0.12}$=0.053;
故答案为:0.053;
(3)根据C8H10(g)?C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)?C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.24mol}{0.4mol}$×100%=60%,
故答案为:60%.
点评 本题考查化学平衡及其相关计算,难度中等,主要是反应速率、平衡常数、转化率和平衡三行计算的分析应用,掌握基础是解题关键.

 阅读快车系列答案
阅读快车系列答案①增大反应物的浓度
②升高温度
③增大压强
④加入催化剂.
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ①③ |
| A. | AlCl3 | B. | Al2O3 | C. | Al(OH)3 | D. | Al |
| A. | 明矾可用作净水剂 | |
| B. | 热的纯碱溶液可用于除去物品表面的油污 | |
| C. | 铵态氮肥和草木灰(主要成分碳酸钾)不能混合使用 | |
| D. | 配制FeCl2溶液时需要向溶液中加少量铁粉 |
| A. | 次氯酸有酸性,可用于漂白、杀菌消毒 | |
| B. | 纯碱能与酸反应,可用作治疗胃酸过多的药物 | |
| C. | 液氨汽化时要吸收大量的热,工业上可用作制冷剂 | |
| D. | 晶体硅的熔点高、硬度大,可用于制作半导体材料 |
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | Na2SO3溶液 | D. | 饱和NaCl溶液 |
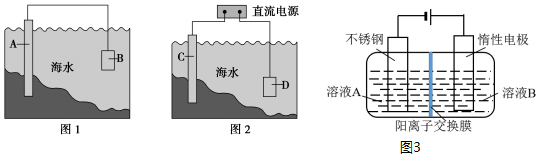
 “套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题: