题目内容
20.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | ${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2氧化能力相近,二者互为同位素 | |
| B. | .过氧化氢的电子式: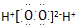 | |
| C. | .同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | .同周期主族元素原子半径随核电荷数的增大而减小 |
分析 A.同位素应为具有相同质子数而中子数不同的原子;
B.过氧化氢为共价化合物;
C.比较非金属性,应从最高价氧化物的水化物的酸性的角度;
D.同周期元素从左到右原子半径逐渐减小.
解答 解:A.${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2为同种元素的单质,而同位素应为具有相同质子数而中子数不同的原子,故A错误;
B.过氧化氢为共价化合物,电子式为 ,故B错误;
,故B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,如不是最高价,则无法比较,故C错误;
D.同周期元素从左到右原子半径逐渐减小,故D正确.
故选D.
点评 本题考查较为综合,涉及电子式、同位素以及元素周期率等知识,为高频考点,难度不大,注意掌握电子式、分子式、结构简式、结构式的概念及区别,把握元素的性质的递变规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.用下列方法均可制得氧气:
①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
②2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
②2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
11.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度
②升高温度
③增大压强
④加入催化剂.
①增大反应物的浓度
②升高温度
③增大压强
④加入催化剂.
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ①③ |
15.下列说法正确的是( )
| A. | 阴离子只有还原性 | |
| B. | 含有最高价元素的化合物,只有氧化性,不具有还原性 | |
| C. | Zn和稀硫酸反应既属于离子反应,也属于氧化还原反应 | |
| D. | 没有单质参加也没有单质生成的反应一定不是氧化还原反应 |
5.下列各组物质中,化学键类型完全相同的是( )
| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和HCl | D. | CCl4和NaCl |
12.相等物质的量的下列物质,分别与足量NaOH溶液反应,消耗NaOH物质的量最多的是( )
| A. | AlCl3 | B. | Al2O3 | C. | Al(OH)3 | D. | Al |
9.下列与盐类水解无关的是( )
| A. | 明矾可用作净水剂 | |
| B. | 热的纯碱溶液可用于除去物品表面的油污 | |
| C. | 铵态氮肥和草木灰(主要成分碳酸钾)不能混合使用 | |
| D. | 配制FeCl2溶液时需要向溶液中加少量铁粉 |
 “套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题: