题目内容
4.25℃时,电离常数Ka(HF)=3.6×10-4mol/L,溶度积Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=4×10-10,Ksp(AgI)=1.0×10-16.下列说法正确的是( )| A. | AgCl不能转化为AgI | |
| B. | 25℃时,0.1mol/L HF溶液pH=l | |
| C. | 25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12mol/L | |
| D. | 向1L0.1mol/LHF溶液中加入1L 0.1mol/LCaCl2溶液,没有沉淀产生 |
分析 A.溶解度小的转化为溶解度更小的容易实现;
B.HF为弱酸,不能完全电离;
C.根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度;
D.据Ksp(CaF2)与Qc(CaF2)判断.
解答 解:A.AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为AgI,故A错误;
B.HF为弱酸,不能完全电离,所以常温下O.1 mol•L-1HF溶液pH>l,故B错误;
C.已知Ksp(AgCl)=4×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{4×1{0}^{-10}}$=2.0×10-5mol/L,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{2.0×1{0}^{-5}}$=5×10-12mol/L,所以加入KI溶液的浓度不低于5×10-12 mol/L,故C正确;
D.向1L0.1 mol•L-1HF溶液中加入1L 0.1 mol•L-1CaCl2溶液,Qc(CaF2)=0.05×0.052=1.25×10-4>Ksp(CaF2)=1.46×10-10,有沉淀生成,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,题目难度中等,注意把握溶度积常数的计算及应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列溶液中Cl-浓度最大的是( )
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 | ||
| C. | 300mL 5mol/L NaClO溶液 | D. | 250mL 1mol/L AlCl3溶液 |
1.反应A(g)+3B(g)═2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A. | v(D)=6 mol•(L•min)-1 | B. | v(C)=0.5 mol•(L•s)-1 | ||
| C. | v(B)=0.6 mol•(L•s)-1 | D. | v(A)=0.15 mol•(L•s)-1 |
12.已知AgCl和AgBr的溶解度分别为S(AgCl)=1×10-4、S(AgBr)=8.4×10-6,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl沉淀多于AgBr沉淀 |
19.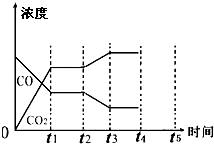 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
请回答下列问题:
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
16.超音速飞机在平流层飞行时,尾气中的NO 会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO 和CO 转变成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO 和CO 浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2})•c^2(C{O}_{2})}{c^2(NO)•c^2(CO)}$.
(2)前2s 内的平均反应速率v(CO2)=3.75×10-4mol/L•s.
(3)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO 转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等 B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变 D.单位时间内消耗1molNO 的同时,就有1molCO 生成.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO 和CO 浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| -c(NO)/mol•L -1 | 1.00×10 -3 | 4.50×10-4 | 2.50×10 -4 | 1.50×10 -4 | 1.00×10 -4 | 1.00×10 -4 |
| -c(CO)/mol•L-1 | 3.60×10 -3 | 3.05×10 -3 | 2.85×10 -3 | 2.75×10 -3 | 2.70×10 -3 | 2.70×10-3 |
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2})•c^2(C{O}_{2})}{c^2(NO)•c^2(CO)}$.
(2)前2s 内的平均反应速率v(CO2)=3.75×10-4mol/L•s.
(3)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO 转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等 B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变 D.单位时间内消耗1molNO 的同时,就有1molCO 生成.
13.高温下,某反应平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
| A. | 该反应的化学方程式为CO+H2O$?_{高温高压}^{催化剂}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 升高温度,平衡右移,逆反应速率减小 |
14.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中,正确的是( )
| A. | Cl2是还原产物 | |
| B. | □处对应的物质为H2O | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 若1mol KMnO4参加反应,转移的电子的物质的量是4mol |
 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: