题目内容
20.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示.下列说法正确的是( )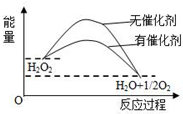
| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
分析 A、催化剂只通过改变活化能来改变反应速率,不改变反应的热效应;
B、催化剂只改变反应速率不改变化学平衡;
C、图象分析反应是放热反应,热化学方程式要注明状态;
D、图象分析反应是放热反应,反应物的总能量高于生成物的总能量.
解答 解:A、催化剂只通过改变活化能来改变反应速率,不改变反应的热效应;故A错误;
B、催化剂只改变反应速率不改变化学平衡,反应体系中加入催化剂不改变H2O2的平衡转化率,故B错误;
C、图象分析判断反应是放热反应,热化学方程式要注明状态,所以H2O2分解的热化学方程式:H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H<0,故C错误;
D、图象分析反应是放热反应,所以反应物的总能量高于生成物的总能量,故D正确;
故选D.
点评 本题考查了化学平衡、化学反应能量的图象分析判断,注意催化剂改变速率不改变平衡的理解,题目难度中等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
12.合成氨时采用700K左右的温度进行,主要是因为在该温度时( )
| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
9.二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
| A. | 都能使品红试液褪色 | |
| B. | 都能和氢氧化钠溶液反应生成盐和水 | |
| C. | 都有刺激性气味 | |
| D. | 常温下都是气体 |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 氯化铁溶液滴加到沸水中得到Fe(OH)3 胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 铁溶于盐酸产生H2:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |

 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. (C10H10O4)的同分异构体中,满足下列条件的有5种.
(C10H10O4)的同分异构体中,满足下列条件的有5种.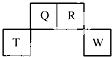 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等, .
.